Переваривание жиров идет в кишечнике
Содержание:
- Хитрый трюк или как метаболит преодолевает митохондриальный барьер
- Биологическая роль селен-цистеин-содержащей тРНК и селенсодержащих протеинов
- Биосинтез триглицеридов
- Всасывание липидов
- Экзогенный путь метаболизма липидов
- Ресинтез липидов в энтероцитах
- Гистохимические методы определения в тканях
- Убихинон
- Образование мицелл
- Эмульгирование и гидролиз липидов
- Долихолы
- Пути эндогенного биосинтеза кометаболитов ХС
- Биосинтез холестерина
- Регуляция плазменного содержания апо-B-липопротеина в норме и при нарушениях липидного обмена
Хитрый трюк или как метаболит преодолевает митохондриальный барьер
Базовый внемитохондриальный биосинтез ЖК, напротив, не имеет общих пересечений с процессом их окисления. Его механизм, требует трех компонент:
- ацетил-КоА – первичный метаболит;
- CO2 – тут без комментариев, вещество общеизвестное;
- ионов бикарбоната – HCO3-.
Метаболит представляет собой строительный фундамент. Изначально ацетил-КоА образуется именно в митохондрии. Его синтез – следствие процесса окислительного декарбоксилирования. Просочиться напрямую в цитоплазму, соединение не может в силу непроницаемости для него митохондриальной мембраны. Удается осуществить проникновение путем обходного маневра:
- Митохондриальный метаболит производит цитрат, посредством взаимодействия с оксалоацетатом.
- Для синтезированного цитрата митохондриальная мембрана прозрачна. Поэтому его молекулы с легкостью пробиваются в цитоплазму.
- Далее происходит обратная трансформация. Едва преодолев мембрану, цитрат расщепляется на исходные компоненты – ацетил-КоА и оксалоацетат.
Таким образом, метаболит передается от митохондрии. В цитоплазме непосредственного получения соединения не происходит. Альтернативный вариант переноса ацетил-КоА возможен при участии карнитина. Однако, в процессе синтеза ЖК, – это своеобразный «бронепоезд, стоящий на запасном пути». Данный канал используется значительно реже.

Биологическая роль селен-цистеин-содержащей тРНК и селенсодержащих протеинов
Селен-цистеин-содержащая тРНК является производным изопентенилированного аденозина-37 (A37), обычно опосредованного модификацией антикодона в положении 3′ (Moustafa M.E. et al., 2001). Селен-цистеин-содержащая тРНК декодирует UGA, который в физиологических условиях блокирует кодон и обеспечивает включение молекулы селен-цистеин в формирующиеся селенсодержащие пептиды. Отсутствие изопентенилированной тРНК проявляется в снижении эффективности деградации селен-цистеин-содержащей тРНК в декодированных нечувствительных кодонах бактериальных и дрожжевых клеток (Warner G.J. et al., 2000). Таким образом, неточная трансляция сигнала остановки процесса кодирования может привести к преждевременному завершению процесса протеинового синтеза и сборке короткоцепочечных белковых молекул.
Биосинтез триглицеридов
Фундаментальными кирпичиками процесса выступают глицерин и ЖК. Изначально формируется промежуточный продукт – глицерол-3-фосфат. Это характерно для процессов биосинтеза, происходящих в почках и стенках кишечника. Клетки органов отличаются гиперактивностью фермента глицеролкиназы, чего нельзя сказать о мышечной и жировой ткани. Тут вещество формируется при помощи гликолиза – окисления глюкозы.
Эффект особенно проявляется при истощении. Вследствие этого, образуется недостаток глюкозы, что приводит к резкому снижению производства глицерол-3-фосфата. Как результат свободные ЖК не используются на ресинтез липидов, просто покидая ткань.
Еще одним источником промежуточного синтеза глицерол-3-фосфат выступает печень. Орган может производить вещество обоими способами, с использованием как глицерина, так и глюкозы, в качестве базового соединения. Впрочем, для синтеза глицерол-3-фосфат главное, что события произошли, поскольку в дальнейшем соединение ацилируется. То есть происходит процесс введения RCO- остатка при помощи молекул ЖК (КоА производные).
Это приводит к синтезу фосфатидной кислоты. В дальнейшем от полученного соединения отщепляется остаток фосфорной кислоты. Реакция дефосфорилирования протекает с участием фосфатидатфосфатазы. Ее продуктом выступает 1,2-диглицерид. До получения триглицерида остается единственный шаг. Он состоит в этерификации. Кислотой выступает 1,2-диглицерид, заместителем спирта – фермент ацил-КоА.

Всасывание липидов
После расщепления полимерных липидных молекул полученные мономеры всасываются в верхнем отделе тонкого кишечника в начальные 100 см. В норме всасывается 98% пищевых липидов.
1. Короткие жирные кислоты (не более 10 атомов углерода) всасываются и переходят в кровь без каких-либо особенных механизмов. Этот процесс важен для грудных детей, т.к. молоко содержит в основном коротко- и среднецепочечные жирные кислоты. Глицерол тоже всасывается напрямую.
2. Другие продукты переваривания (длинноцепочечные жирные кислоты, холестерол, моноацилглицеролы) образуют с желчными кислотами мицеллы с гидрофильной поверхностью и гидрофобным ядром. Их размеры в 100 раз меньше самых мелких эмульгированных жировых капелек. Через водную фазу мицеллы мигрируют к щеточной каемке слизистой оболочки. Здесь мицеллы распадаются и липидные компоненты диффундируют внутрь клетки, после чего транспортируются в эндоплазматический ретикулум.
Желчные кислоты также здесь могут попадать в энтероциты и далее уходить в кровь воротной вены, однако бóльшая их часть остается в химусе и достигает подвздошной кишки, где всасывается при помощи активного транспорта.
Экзогенный путь метаболизма липидов
Более 95% липидов, поступающих с пищей, представлены ТГ, остальное количество составляют фосфолипиды, СЖК, ХС, который присутствует в пищевых продуктах преимущественно в виде эстерифицированного ХС, а также жирорастворимые витамины. В желудке и двенадцатиперстной кишке под влиянием солей желчных кислот осуществляется процесс эмульгирования липидов (рис. 2.1). Натриевые соли желчных кислот, располагаясь на поверхности капелек липидов, снижают их поверхностное натяжение и способствуют дисперсии последних, увеличивая их суммарную поверхность. Образующаяся тонкодисперсная эмульсия липидов в воде облегчает их взаимодействие с панкреатической липазой. Под действием последней ТГ превращаются в моноглицериды и СЖК. Эфиры ХС, содержащиеся в пище, подвергаются деэстерификации в свободный ХС также под влиянием липаз. Моноглицериды, СЖК и свободный ХС эмульгируются желчными кислотами и затем абсорбируются энтероцитами, после чего конденсируются с ТГ и вместе с ХС включаются в состав хиломикронов. Кроме того, моноглицериды и СЖК вместе с солями желчных кислот в тонком кишечнике образуют мицеллы, размеры которых сопоставимы с размерами молекул липидов. Мицеллы всасываются энтероцитами тонкого кишечника посредством эндоцитоза. В энтероцитах осуществляется ресинтез ТГ из моноглицеридов и СЖК мицелл. Ресинтезированные ТГ энтероцитарного происхождения в дальнейшем инкорпорируются в хиломикроны. Таким образом, хиломикроны являются основной транспортной формой экзогенных ТГ, осуществляя их трансфер из энтероцитов тонкого кишечника в системный кровоток через воротную вену и грудной лимфатический проток. В качестве главного структурного протеина хиломикроны содержат апо-В48-протеин, а период их полужизни обычно не превышает 5–20 мин. Необходимо отметить, что плазма крови здоровых людей при взятии крови натощак практически не содержит хиломикронов.
После секреции хиломикроны получают аполипопротеины классов Е, С-I, C-II и C-III от ЛПВП. В плазме крови апо-C-II-липопротеин активирует эндотелиальную липопротеинлипазу. Под действием последней большинство ТГ в хиломикронах расщепляется до глицерина и свободных НЭЖК. Белково-липидный комплекс, ответственный за их транспорт, отличается очень высокой плотностью и малыми размерами. НЭЖК используются в жировой и мышечной ткани в качестве энергетического субстрата. В то же время хиломикроны подвергаются так называемому метаболическому ремоделированию с образованием остатков (ремнантов) с более низкой плотностью: ЛПОНП и ЛППП. Ремнанты хиломикронов, содержащие апо-В48-липопротеин и обогащенные апо-Е-липопротеином, захватываются гепатоцитами с помощью специфических рецепторов, имеющих высокое сродство к последнему. В дальнейшем ТГ, ассоциированные с ремнантами хиломикронов, подвергаются воздействию внутрипеченочной липопротеинлипазы. В результате ресинтезируются СЖК и глицерин, которые используются для продукции липидов, либо вовлекаются в процессы β-окисления.
Желчные кислоты, всасывающиеся в тонком кишечнике, по системе воротной вены транспортируются в гепатоциты, а затем секретируются в желчные капилляры вместе с ресинтезированными желчными кислотами. Подобная внутрипеченочная рециркуляция предотвращает экзогенные потери желчных кислот и поддерживает синтез ХС в гепатоцитах на относительно стабильном уровне.
Экзогенный ХС в ограниченном количестве (не более 0,5 г/сут) всасывается в кишечнике в составе липидных мицелл. Далее он в составе хиломикронов достигает гепатоцитов, где подвергается эстерификации, либо превращается в соли желчных кислот. Причем интенсивность секреции ХС в желчный капилляр и ретенция в гепатоците, регулируемая специфическими молекулами ABCG5 и ABCG8 (ATP (adenosine triphosphate)-binding cassette (ABC) transporter G5 и G8 — АТФ (аденозинтрифосфат)-связанный кассетный переносчик G5 и G8), являются взаимо взвешенными процессами (Yu L. et al., 2002).
Биосинтез эндогенного ХС из ацетил-КоА осуществляется в основном в гепатоцитах и в следовых количествах — в энтероцитах тонкого кишечника. Часть ХС выводится с желчью, а другая — подвергается эстерификации.

Рис. 2.1. Основные пути метаболизма липидов
На рис. 2.1, 2.2 и 2.3: ЛХАТ — лецитин-холестерин-ацетилтрансфераза, CETP (cholesteryl ester transfer protein) — протеин, транспортирующий эстерифицированный ХС, НУ – низкий уровень, ВУ — высокий уровень.
Ресинтез липидов в энтероцитах
Ресинтез липидов – это синтез липидов в стенке кишечника из поступающих сюда экзогенных жиров, одновременно могут использоваться и эндогенные жирные кислоты, поэтому ресинтезированные жиры отличаются от пищевых и более близки по составу к «своим» жирам. Основная задача этого процесса – связать поступившие с пищей средне- и длинноцепочечные жирные кислоты со спиртом – глицеролом или холестеролом. Это, во-первых, ликвидирует их детергентное действие на мембраны и, во-вторых, создает их транспортные формы для переноса по крови в ткани.
Активация жирной кислоты
Поступившая в энтероцит (как и в любую другую клетку) жирная кислота обязательно активируется через присоединение коэнзима А. Образовавшийся ацил-SКоА участвует в реакциях синтеза эфиров холестерола, триацилглицеролов и фосфолипидов.
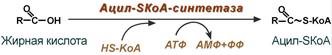
Реакция активации жирной кислоты
Ресинтез эфиров холестерола
Холестерол этерифицируется с использованием ацил-SКоА и фермента ацил-SКоА:холестерол-ацилтрансферазы (АХАТ).
Реэтерификация холестерола напрямую влияет на его всасывание в кровь. В настоящее время ищутся возможности подавления этой реакции для снижения концентрации ХС в крови.

Реакция ресинтеза эфиров холестерола
Ресинтез триацилглицеролов
Для ресинтеза ТАГ есть два пути:
Первый путь, основной – 2-моноацилглицеридный – происходит при участии экзогенных 2-МАГ и ЖК в гладком эндоплазматическом ретикулуме энтероцитов: мультиферментный комплекс триацилглицерол-синтазы формирует ТАГ.

Моноацилглицеридный путь образования ТАГ
Поскольку 1/4 часть ТАГ в кишечнике полностью гидролизуется, а глицерол в энтероцитах не задерживается и быстро переходит в кровь, то возникает относительный избыток жирных кислот для которых не хватает глицерола. Поэтому существует второй, глицеролфосфатный, путь в шероховатом эндоплазматическом ретикулуме. Источником глицерол-3-фосфата служит окисление глюкозы. Здесь можно выделить следующие реакции:
- Образование глицерол-3-фосфата из глюкозы.
- Превращение глицерол-3-фосфата в фосфатидную кислоту.
- Превращение фосфатидной кислоты в 1,2-ДАГ.
- Синтез ТАГ.
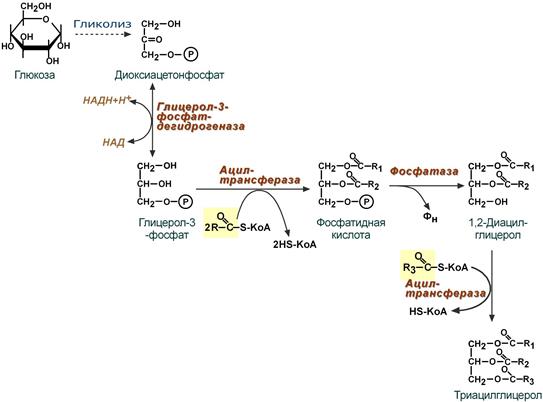
Глицеролфосфатный путь образования ТАГ
Ресинтез фосфолипидов
Фосфолипиды синтезируются также, как и в остальных клетках организма (см «»). Для этого есть два способа:
Первый путь – с использованием 1,2-ДАГ и активных форм холина и этаноламина для синтеза фосфатидилхолина или фосфатидилэтаноламина.

Ресинтез фосфолипидов из ДАГ на примере фосфатидилхолина
Второй путь – на основе синтезируемой in situ фосфатидной кислоты.
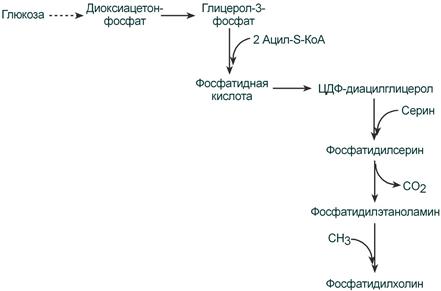
Схема ресинтеза фосфолипидов из фосфатидной кислоты
После ресинтеза фосфолипиды, триацилглицеролы, холестерол и его эфиры упаковываются в особые транспортные формы липидов – липопротеины и только в такой форме они способны покинуть энтероцит и транспортироваться в крови. В кишечнике формируются два вида липопротеинов – хиломикроны и липопротеины высокой плотности (ЛПВП), другие типы липопротеинов здесь не образуются.
Гистохимические методы определения в тканях
Самым старым методом окрашивания Л. в тканях является метод с использованием четырехокиси осмия (OsO4). Этот реактив восстанавливается непредельными жирными к-тами и целым рядом других веществ, обладающих восстанавливающими свойствами. Продукты восстановления OsO4 окрашены в черный цвет. Однако следует признать, что методы выявления Л. с помощью жирорастворимых красителей более просты и надежны. В гистохимии для этих целей прежде всего стали использовать судан III, несколько позже — судан IV и шарлах. Л. более интенсивно окрашиваются красящими смесями, особенно теми, которые содержат два (или более) гомолога или изомера нафтоловых суданов. Окрашивание Л. жирорастворимыми красителями основано на том, что они растворяются в жировых веществах лучше, чем в обычных растворителях. Термин «суданофилия» означает способность ткани окрашиваться любыми жирорастворимыми красителями.
Для сохранения Л. в тканях при фиксации рекомендуется использовать 10 — 15% р-р формалина, но еще лучше использовать фиксатор формол-кальций по Бейкеру: формалин— 10 мл; 10% хлористый кальций — 10 мл; дистиллированная вода — 80 мл.
К этому фиксатору должен быть добавлен мел, для того чтобы смесь имела нейтральную реакцию. Фиксировать ткань рекомендуется 24—48 час., более длительная фиксация может привести к образованию кристаллов, изменению растворимости Л. и т. д. Отмытая после фиксации ткань промывается в проточной воде; срезы готовятся на замораживающем микротоме. Ткань паренхиматозных органов можно предварительно заключить в желатину.
При окрашивании ткани на Л. дает хорошие результаты и одновременно выявляет суданофильную зернистость в сегментоядерных лейкоцитах метод Гольдмана. Р-р судана III для окраски тканей по этому методу готовится следующим образом: 70% этанол — 100 мл; дистиллированная вода —- 20 мл; альфа-нафтол — 1,2 г; судан III — в избытке.
Смесь кипятят в течение 10 мин. и фильтруют. Срезы ткани красят 15 мин., затем дифференцируют в 70% этаноле, контролируя процесс под микроскопом. Мазки крови фиксируют 3 мин. смесью, состоящей из 1 части формалина и 4 частей 96 % этанола.
При окраске тканей на Л. по методу Чаччо следует маленькие кусочки фиксировать в течение 24—48 час. в смеси следующего состава: 5% водный р-р двухромовокислого калия — 80 мл; формалин — 20 мл; ледяная уксусная к-та — 5 мл.
Затем кусочки ткани выдерживают 5 — 8 дней в 3% двухромовокислом калии («хромируют»), сутки промывают в проточной воде, проводят через этанол восходящих концентраций в течение суток, проводят через ксилол и заключают в парафин. Приготовленные срезы после обработки 70% этанолом красят насыщенным р-ром судана III в 70% этаноле или при температуре 50° красителем следующего состава: 80 % этанол — 95 мл; ацетон — 5 мл; судан III — до насыщения.
После охлаждения жидкость фильтруется. Срезы красят 30 — 60 мин. при температуре 30°, споласкивают 50% этанолом, промывают в дистиллированной воде и заключают в глицерин-желатину.
Ядра клеток можно красить на Л. квасцовым гематоксилином, лучше это делать до обработки срезов су-даном. Л. окрашиваются в оранжевокрасный цвет.
Библиография: Алимова Е. К., Аствацатурьян А. Т. и Жаров Л. В. Липиды и жирные кислоты в норме и при ряде патологических состояний, М., 1975; Биохимические методы исследования в клинике, под ред. А. А. Покровского, М., 1969; Кейтс М. Техника липидологии, пер. с англ., М., 1975; Комаров Ф. И., Коровкин Б. Ф. и Меньшиков В. В. Биохимические исследования в клинике, Л., 1976; Липиды, под ред. С. Е. Северина, М., 1977; Меркулов Г. А. Курс патологогистологической техники, с. 241, Л., 1969; П и р с Э. Гистохимия, пер., с англ., с, 259, М., 19 62; Lipids, ed. by R. Paoletti а. о., v. 1—2, N. Y., 1976; Masoro E. J. Physiological chemistry of lipids in mammals, Philadelphia, 1968; Searcy R. L. Lipopa-thies, Springfield, 1971.
Убихинон
Убихинон (коэнзим Q10) состоит из гексамерного хинольного кольца (Q) и десяти остатков цепи молекулы изопрена. Он принимает участие как постоянный компонент цикла Кребса в акцепции окисленных остатков от фиксированных флавоноидных комплексов и транспортирует их далее по цитохромам дыхательной цепи митохондрий.
Таким образом, ХС является структурным компонентом биологических мембран, участвует в процессах биосинтеза ряда витаминов, стероидных гормонов, желчных кислот, а также коферментов, играющих важную роль в регуляции процессов пластического и метаболического обмена веществ.
Образование мицелл
В результате воздействия на эмульгированные жиры ферментов панкреатического и кишечного соков образуются 2-моноацилглицеролы, свободные жирные кислоты и свободный холестерол, формирующие структуры мицеллярного типа (размер уже около 5 нм). Свободный глицерол всасывается напрямую в кровь.
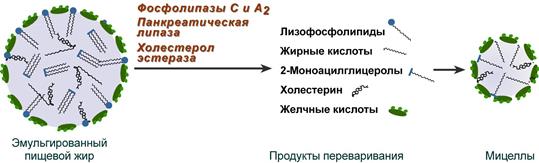
Схематичное изображение переваривания липидов
Полученные смешанные мицеллы достигают эпителия кишечника и их компоненты диффундируют в клетки и попадают в гладкую эндоплазматическую сеть. Желчные кислоты почти не всасываются и остаются в просвете кишечника. Далее желчные кислоты достигают подвздошной кишки и всасываются там ().
Эмульгирование и гидролиз липидов
Первые два этапа переваривания липидов, эмульгирование и гидролиз, происходят практически одновременно. Вместе с этим, продукты гидролиза не удаляются, а оставаясь в составе липидных капелек, облегчают дальнейшее эмульгирование и работу ферментов.
Переваривание в ротовой полости
У взрослых в ротовой полости переваривание липидов не идет, хотя длительное пережевывание пищи способствует частичному эмульгированию жиров.
Переваривание в желудке
Собственная липаза желудка у взрослого не играет существенной роли в переваривании липидов из-за ее небольшого количества и того, что ее оптимум рН 4,5-5,5. Также влияет отсутствие эмульгированных жиров в обычной пище (кроме молока).
Тем не менее, у взрослых теплая среда и перистальтика желудка вызывает некоторое эмульгирование жиров
При этом даже низко активная липаза расщепляет незначительные количества жира, что важно для дальнейшего переваривания жиров в кишечнике, т.к. наличие хотя бы минимального количества свободных жирных кислот облегчает эмульгирование жиров в двенадцатиперстной кишке и стимулирует секрецию панкреатической липазы
Переваривание в кишечнике
Под влиянием перистальтики ЖКТ и составных компонентов желчи пищевой жир эмульгируется. Образующиеся при переваривании лизофосфолипиды также являются хорошим поверхностно-активным веществом, поэтому они способствуют дальнейшему эмульгированию пищевых жиров и образованию мицелл. Размер капель такой жировой эмульсии не превышает 0,5 мкм.
Гидролиз эфиров ХС осуществляет холестерол-эстераза панкреатического сока.
Роль колипазы в действии липазы |
Переваривание ТАГ в кишечнике осуществляется под воздействием панкреатической липазы с оптимумом рН 8,0-9,0. В кишечник она поступает в виде пролипазы, для проявления ее активности требуется колипаза, которая помогает липазе расположиться на поверхности липидной капли.
Колипаза, в свою очередь, активируется и затем образует с липазой комплекс в соотношении 1:1. Панкреатическая липаза отщепляет жирные кислоты, связанные с С1 и С3 атомами углерода глицерола. В результате ее работы остаются 2-моноацилглицеролы (2-МАГ), которые всасываются или превращаются моноглицерол-изомеразой в 1-МАГ. Последний гидролизуется до глицерола и жирной кислоты. Примерно 3/4 ТАГ после гидролиза остаются в форме 2-МАГ и только 1/4 часть ТАГ гидролизуется полностью.

Полный ферментативный гидролиз триацилглицерола
В панкреатическом соке также имеется активируемая фосфолипаза А2, отщепляющая в фосфолипидах жирную кислоту от С2, также обнаружена активность фосфолипазы С и лизофосфолипазы.

Действие фосфолипазы А2 и лизофосфолипазы на примере фосфатидилхолина
В кишечном соке также имеется активность фосфолипазы А2 и фосфолипазы С.
Для работы всех указанных гидролитических ферментов в кишечнике необходимы ионы Са2+, способствующие удалению жирных кислот из зоны катализа.
Точки действия фосфолипаз
Долихолы
Долихолы являются дериватами ФПФ и изопентил-1-пирофосфата, обычно содержащими 16–22 молекулы изопрена, протяженность единственной цепи которых чрезвычайно варьирует в зависимости от типа клеток у организмов разных видов. Долихолы опосредуют N-терминальное гликозилирование образующихся полипептидов, которые участвуют в транспорте и депонировании олигосахаридного ядра, необходимого для последующей гликации белков. Гликозилирование — это достаточно сложный процесс модификации протеинов, являющийся, однако, интегральным компонентом в реализации биологической функции белков.
Пути эндогенного биосинтеза кометаболитов ХС
ХС широко включается в процессы метаболизма, входит в число естественного компонента биологических мембран и рассматривается как основной источник для последующего синтеза стероидных гормонов, витамина D и желчных кислот. Процессы биосинтеза эндогенного ХС осуществляются в эндоплазматическом ретикулуме и цитозоле. Последовательная конденсация трех молекул ацетил-КоА при участии тиолазы и 3-гидрокси-3-метилглутарил-КоА синтетазы (ГМГ-КоА-синтетазы) приводит к образованию ГМГ-КоА. В последующем превращение ГМГ-КоА в мевалонат осуществляется с помощью ГМГ-КоА-редуктазы, а сама реакция рассматривается как ключевая в синтезе эндогенного ХС (рис. 2.5).

Рис. 2.5. Ключевые этапы биосинтеза эндогенного ХС
Одними из важных промежуточных продуктов этого метаболического пути являются геранилпирофосфат (ГПФ) и фарнезилпирофосфат (ФПФ). Они представляют собой дериваты изопентил пирофосфата и его изомера диметилалил пирофосфата, структурно относящиеся к изопреновым производным (McTaggart S.J., 2006). Кроме биосинтеза ХС, ГПФ и ФПФ вовлечены в посттрансляционную модификацию (то есть прениляцию) различных внутриклеточных протеинов, в свою очередь, являющихся прекурсорами для дальнейшего синтеза важных метаболитов, таких как долихол и убихинон.
Биосинтез холестерина
Ферментативный процесс образования ХС – достаточно сложная «многоходовая комбинация», насчитывающая более 35 энзиматических реакций. Очевидно, что охватить подобный объем преобразований не под силу даже Остапу Бендеру. Поэтому проще рассмотреть базовые стадии биосинтеза холестерола:
- Получение мевалоновой кислоты. Происходит в эукариоте – домене живых организмов. Требует три молекулы активного ацетата.
- Формирование сквалена. Прекурсором выступает ранее произведенная мевалоновая кислота. Изначально соединение трансформируется в активный изопреноид, из 6 молекул которого и образуется сквален.
- Синтез холестерина. Процесс осуществляется циклизацией сквалена. Синтезируется своеобразный прекурсор – ланостерин, переход которого в ХС все еще находится под изучением.
Первоначально биосинтез инициируется формированием ацетоацетил-КоА. Далее, структура подвергается конденсации с 3-ей молекулой активного ацетата. Полученное производное вещество вступает в реакцию восстановления, что и приводит к формированию мевалоната.
Следующий шаг в биосинтезе ХС – превращение мевалоната в сквален. Изначально, соединение подвергается переносу остатка фосфорной кислоты при помощи фермента АТФ. Продуктом реакции выступает 5′-пирофосфорный эфир. Впрочем, соединение не долговечно. Оно практически моментально трансформируется, в эфир мевалоната. Цепочка последующих преобразований достаточно запутана, поэтому проще ограничиться фактом. Результатом этих процессов становится образование сквалена. Реакция циклизации соединения приводит к формированию ланостерина, с последующим биосинтезом холестерола.
Остается добавить, что преимущественно процесс протекает в печени. Поэтому дисфункции органа, способны вызывать нарушения липидного баланса. При нормальной работе, печень производит ежесуточную норму холестерина, с учетом вещества, поступающего с продуктами. Этот факт еще раз опровергает распространенное заблуждение о вреде пищи с высоким содержанием холестерина. Здоровая печень, способна самостоятельно контролировать уровень вещества.
https://youtube.com/watch?v=mzIeQo26NWI
Регуляция плазменного содержания апо-B-липопротеина в норме и при нарушениях липидного обмена
Концентрация апо-B-содержащих липопротеидов в плазме крови является результатом метаболического регулирования их продукции, изменения клиренса или конверсии. Наиболее типичные виды метаболического регулирования содержания апо-В представлены на рис. 2.4. В физиологических условиях, ЛПОНП1 являются основными липопротеидами, секретирующимися гепатоцитами. Непосредственно после синтеза ЛПОНП1 конвертируются в ЛПОНП2, а последние — в ЛППП, при этом их концентрация в плазме крови сохраняется достаточно низкой именно за счет высокой скорости конвертации. С другой стороны, ЛПНП значительно медленнее выводятся из циркуляции (период циркуляции составляет 2–4 сут), что приводит к относительному преобладанию этого типа липопротеидов по отношению к другим фракциям. С возрастом продукция апо-В-липопротеина обычно повышается, что ассоциируется со снижением экспрессии рецепторов к ЛПНП (Matthan N.R. et al., 2005). При некоторых состояниях, например, при ожирении, синтез ЛПОНП особенно высок, что способствует увеличению плазменного уровня апо-В и ЛПНП (Chan D.C. et al., 2004). Установлено, что повышение уровня ЛПОНП1 может сопровождаться гиперинсулинемией даже у здоровых лиц (Malmstrom R. et al., 1997). При инсулинорезистентности недостаточная регуляция продукции ЛПОНП негативно отражается на плазменном уровне апо-B-липопротеина, что способствует повышению концентрации ЛПОНП, ЛППП, ЛПНП, формируя проатерогенную гиперлипидемию (Taskinen M.R., 2003).

Рис. 2.4. Метаболическая регуляция уровня апо-B-липопротеина в плазме крови. Модифицирован из работы C.J. Packard и соавт., 2000
У лиц со значительным повышением уровня ХС ЛПНП (>4,5 ммоль/л) в плазме крови выявляют увеличение содержания апo-B-липопротеинов преимущественно за счет редукции клиренса рецепторов к ним. Последние представляют собой регулируемые мембранассоциированные протеины, ответственные за распознавание и интернационализацию липопротеинов, а также активное поступление ХС в клетки (Turley S.D., 2004). Снижение экспрессии рецепторов или различные варианты качественного изменения в структуре их субъединиц являются морфологической основой возникновения ряда наследственных нарушений липидного обмена, таких как семейная гиперхолестеринемия (см. главу 6). Необходимо отметить, что концентрация ЛПНП может подвергаться непосредственному метаболическому регулированию со стороны ЛПОНП2, уровень которых, в свою очередь, зависит от ЛПОНП1 (Gaffney D. et al., 2002).
У пациентов с изолированной гипертриглицеридемией обычно отмечают избыточную продукцию ЛПОНП (особенно ЛПОНП1) на фоне неэффективного липолиза (Chan D.C. et al., 2004). Это приводит к повышению содержания апо-В в плазме крови, поскольку последний является транспортной формой как для ЛПОНП1, так и для ЛПОНП2. Кроме того, у таких больных не только существенно снижен клиренс апо-В-содержащих липопротеидов, но и имеется возможность для их более интенсивной модификации. Так, CETP транспортирует ТГ от ЛПОНП к ЛПНП и ЛПВП, тогда как эстерифицированный ХС перемещается в обратном направлении. При этом апо-C-II, апо-C-III и апо-Е поочередно включаются в состав липопротеидов, заменяя друг друга. Все это приводит к тому, что в длительно циркулирующих в плазме крови молекулах ЛПОНП снижается содержание aпo-C-липопротеина, тогда как удельный вес aпo-E и эстерифицированного ХС возрастает. Подобная модификация ЛПОНП способствует появлению резистентности последних к липазе и обусловливает формирование так называемых ремнантных форм ЛПОНП (Havel R.J., 2000).