Инсулин с
Содержание:
- Применение инсулина при беременности
- Техника введения инсулина при помощи шприц-ручки:
- С инсулиновой помпой можно:
- Барьеры для осуществления инсулинотерапии и неудовлетворенные потребности: упор на гипогликемию
- Секреция инсулина и ее нарушения
- Нобелевская премия
- Высыпания на коже при гинекологических проблемах
- Расчет схемы лечения инсулином
- Варианты введения инсулина
- Превращение инсулина в организме
- Инсулиновая помпа
- Сахарный диабет 2 типа — беспомощность инсулина
- Предпосылки создания инсулина
- Тема 2. Действие инсулина
Применение инсулина при беременности
Рискам развития сахарного диабета на фоне беременности, равно как и ведению беременности у женщины с уже подтвержденным диагнозом, уделяется особое внимание. К общим рекомендациям относят:
ведение беременности специалистами из разных областей медицины (акушер-гинеколог, эндокринолог, диетолог, возможно прочие);
соблюдение специально разработанной диеты — калорийность суточного рациона рассчитывается в 30-35 ккал/кг идеальной массы тела (в среднем 1800-2400 ккал); 40-45% калорийности отводится на углеводы, 20-30% — на белки и 30% — на жиры; важно исключить легкоусвояемые углеводы, принимать пищу 5-6 раз в день с 2-3-часовыми интервалами; прибавка массы тела не должна превышать 10 кг, а при наличии ожирения — 7 кг;
соблюдение режима физической активности, избегание чрезмерных физических и эмоциональных усилий;
посещение женской гинеколога и эндокринолога дважды в неделю в первой половине беременности и еженедельно во второй;
проведение УЗИ на 15-20 неделе для исключения грубых пороков развития, на 20-23 неделе для исключения пороков сердца, на 28-32 неделе для раннего выявления макросомии, задержки внутриутробного развития плода, оценки объема околоплодных вод, в канун родов для исключения макросомии плода и решения вопроса о тактике ведения родов;
определение уровня альфа-фетопротеина в сыворотке крови на 15-20 неделе, периодическое определение уровня гликолизированного гемоглобина, повторная офтальмоскопия в третьем триместре для решения вопроса о возможности физиологического ведения родов.
Выбору сахароснижающих препаратов для назначения беременным отводится особое внимание. Пероральные сахароснижающие препараты не рекомендованы, а потому инсулин оказывается единственным сахароснижающим средством в данной ситуации
На сегодняшний день инсулин лизпро по риску применения во время беременности относят к классу В, а инсулин аспарт и инсулин гларгин — к классу С; их использование во время беременности остается темой для обсуждений.
Гестационный сахарный диабет изначально является поводом для компенсирующей диетотерапии и лишь при неэффективности диетических мероприятий назначается инсулинотерапия, идеальный — интенсивная схема.
При наличии у беременной сахарного диабета в анамнезе (любого типа) интенсивная инсулинотерапия является методом выбора, поскольку способна предотвратить неблагоприятное воздействие гипергликемии на организм матери и ребенка. Традиционно введение инсулина осуществляют с помощью инсулиновых шприцев (используют флаконы с концентрацией инсулина 100 ЕД/мл).
Адекватно составленная инсулинотерапия женщине в период беременности позволяет предотвратить развитие осложнений и у нее, и у плода. Цель таковой — максимально приблизить обмен глюкозы к нормальному и не допустить при этом гипергликемии, кетоацидоза или тяжелой гипогликемии.
Поддержание уровня глюкозы в крови обеспечивается посредством применения человеческого инсулина. Начальную дозу инсулина рассчитывают с учетом массы тела женщины и срока беременности. Так, в I триместре она может быть равна 0,6 ЕД/кг, во II триместре — 0,7 ЕД/кг и в III триместре — 0,8 ЕД/кг. Для беременных с низкой массой тела начальные суточные дозировки препарата могут составлять 0,4; 0,5 и 0,6 ЕД/кг соответственно триместрам.
Обычно 2/3 общей суточной дозы инсулина вводят перед завтраком, 1/3 — перед ужином. Примерно треть утренней дозы приходится на инсулин короткого действия, 2/3 — на инсулин средней длительности действия.
В период родовой деятельности показано применение дробных дозировок инсулина с параллельным контролем гликемии, коррекцией ее уровня 5%-ым раствором глюкозы внутривенно. В день родов начальная доза инсулина может составлять ¼ от суточной с последующим внутривенным введением по 2-3 ЕД/ч вместе с 100-150мл 5%-ого раствора глюкозы и параллельным контролем гликемии. После родов дозу инсулина вдвое-втрое уменьшают.
При оперативном родоразрешении в день операции больную не кормят и ей не вводят инсулин. Во время операции при гликемии менее 8 ммоль/л инсулин не вводят, а при гликемии более 8 ммоль/л коррекцию производят простым инсулином короткого действия. На 4-5-е сутки после операции больную переводят на препараты пролонгированного действия.
Техника введения инсулина при помощи шприц-ручки:
- Подготовьте шприц-ручку. Если нужно ввести НПХ-инсулин (мутный), его следует хорошо перемешать (10 раз согнуть в локте вытянутую руку со шприц-ручкой, пока раствор не станет равномерно мутным).
- Перед набором дозы при каждой инъекции рекомендуется выпустить 1-2 единицы инсулина в воздух для того, чтобы удостовериться в работоспособности шприц- ручки.
- При помощи наборного кольца выставьте необходимую дозу в окошке корпуса.
- Оголите место на коже, куда будете вводить инсулин. Протирать спиртом место инъекции не нужно
- Большим и указательным пальцами возьмите кожу в складку (кроме случаев введения инсулина в область бедра иглой 5-6 мм, в этом случае этот пункт пропускается)
- Введите иглу у основания кожной складки под углом 40-60 градусов (при введении инсулина в область бедра 5-6 мм иглой угол 90 градусов).
- Не отпуская складку (!), нажмите до упора на поршень шприца.
- Отпустите складку и одновременно извлеките наполовину иглу.
- Подождите несколько секунд (нужно посчитать до 10).
- Если все сделано правильно, то на конце иглы будет капелька инсулина, а место инъекции после отведения глаз Вы не найдете (не будет крови или вытекшего обратно инсулина).
С инсулиновой помпой можно:
• испытывать любые физические нагрузки без необходимости предварительного приёма пищи;
• есть что хотите и когда хотите;
• снизить уровень глюкозы крови вплоть до нормализации показателей;
• снизить уровень в крови гликозилированного гемоглобина, что предотвратит развитие или прогрессирование поздних осложнений диабета (ретинопатии, нефропатии, нейропатии и проч.)
• значительно снизит количество инъекций: поступление инсулина осуществляется по пластиковому катетеру со сменой катетера и места инъекции один раз в три дня;
• уменьшить суточную потребность в инсулине на 20-25% за счет увеличения чувствительности к нему;
• высокая точность дозирования – минимальный шаг введения инсулина составляет 0,1 ЕД – позволяет использовать помповую инсулинотерапию даже у совсем маленьких детей;
• значительно снизить частоту случаев гипогликемических состояний (вплоть до полного исчезновения);
• улучшить качество жизни – изменение режима подачи инсулина в любое время суток в соответствии с образом жизни.
Барьеры для осуществления инсулинотерапии и неудовлетворенные потребности: упор на гипогликемию
Остаётся несколько барьеров для внедрения инсулина и оптимального его использования в клинической практике, как на уровне больного, так и на уровне врача. Наиболее распространенные причины для отказа от начала инсулинотерапии у больных СД 2-го типа это:
- страх гипогликемии,
- увеличение веса,
- дискомфорт, связанный с необходимостью регулярного анализа крови,
- боль от инъекций,
- мнение, что инсулинотерапия является сложным и трудоемким процессом.
На приверженность инсулинотерапии, однако, большее влияние оказывают такие факторы, как структура медицинского страхования и занятость.
Страх гипогликемии воздействует не только на решение о начале инсулинотерапии, но он может также поставить под угрозу адекватность гликемического контроля.
Сообщалось, что большинство врачей лечило бы пациентов в более агрессивной манере без адекватного контроля уровня глюкозы, если бы не опасения по поводу гипогликемии.
Бремя гипогликемии у пациентов с СД, получающих инсулинотерапию
Гипогликемия — существенный побочный эффект терапии СД, так как она
ухудшает качество жизни пациентов.
Обсервационные исследования показывают, что
- гипогликемия встречается у 42.89 случаев/пациента-год при СД 1 типа,
- 16.36 случаев/пациента-год у получающих инсулинотерапию пациентов с СД 2 типа.
Частота тяжелой гипогликемии составляет примерно
- 1.15 случаев/пациента-год и может достигать 3.2 случаев/пациента-год при СД 1-го типа;
- 0.7 случаев/пациента-год у получающих инсулинотерапию пациентов с СД 2 типа.
Ночные гипогликемии, которые происходят во время сна, особенно опасны, так как пациенты вряд ли распознают симптомы или проснутся во время такого эпизода.
- В рамках исследования DCCT было сообщено о 43 и 55 % всех гипогликемических и тяжелых гипогликемических случаях, соответственно, которые произошли во время сна.
- Большой интернет-опрос, проведенный в США среди 7.239 участников с СД 2-го типа (28.7 % на инсулинотерапии), показал, что гипогликемия
- препятствовала социальной активности,
- вызывала больше прогулов работы,
- снижение общей производительности труда,
- негативно сказывалась на общем качестве жизни.
- Другое исследование, выполненное в США и Европе, свидетельствует о том, что даже нетяжелые гипогликемические состояния оказывают сильное влияние на производительность труда
- с потерями, составляющими от U$ 15.26 до U$ 93.47
- с уменьшением рабочего времени от 8.3 до 15,9 ч в месяц.
- Дальнейшие исследования показали, что пациенты с подтвержденными случаями гипогликемии имели значительное ухудшение качества жизни, большие нарушение настроения и меньшую удовлетворенность работой.
- Были также конкретно изучены последствия развития ночной гипогликемии. В опрос вошли пациенты с СД, набранные в США, Канаде и 7 европейских странах, которые пережили нетяжелые ночные гипогликемии в предыдущем месяце.
- Другой опрос, включавший 8286 пациентов из 5 стран (США, Канада, Германия, Швеция и Объединённое Королевство), показал, что качество жизни с ночными гипогликемиями хуже, чем с дневными.
- Другие исследования также сообщили о пагубных последствиях ночной гипогликемии на качество жизни, включая влияние на членов семьи и сопутствующие факторы.
- Возможная связь гипогликемии с неврологической недостаточностью также вызывает тревогу.
Частота гипогликемических эпизодов может приводить к тому, что пациенты начинают избегать приёма лекарств, со значительным сокращением или даже отменой дозы инсулина после случая гипогликемии, что негативно отражается на гликемическом контроле.
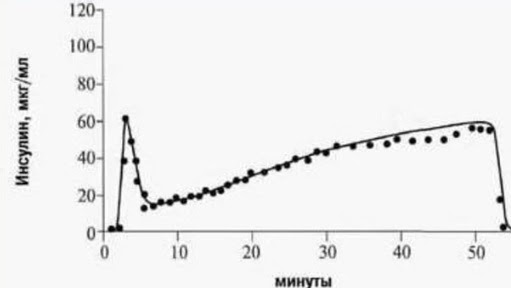
Секреция инсулина и ее нарушения
Для нормального течения обменных процессов важно, чтобы инсулин вырабатывался в нужном объеме. Минимальное количество этого гормона продуцируется всегда
Речь идет о базальной секреции инсулина. После еды и поступления глюкозы в кровь происходит активный выброс гормона – так называемый прандиальный пик. Это необходимо, чтобы глюкоза могла поступить в клетки органов и тканей.
При нормальной работе поджелудочной железы выработка инсулина после приема пищи происходит в две фазы. Быстрая фаза длится 1-3 минуты, медленная — до получаса.
Уровень инсулина в крови здоровых людей колеблется в широком диапазоне. Он зависит от возраста и физиологического состояния. У детей это значение составляет от 3 до 20 мкЕд/мл, у взрослых верхний порог достигает 25 мкЕд/мл.
У женщин во время беременности и после менопаузы происходят существенные изменения гормонального фона. Нормальные показатели инсулина в этом случае составляют от 6 до 27/36 мкЕд/мл.
Нарушением считается не только пониженная секреция гормона, но и повышенная. Существует несколько факторов, из-за которых поджелудочная железа не может вырабатывать инсулин в нужном количестве:
- СД первого типа. Патологический процесс обусловлен аутоиммунной реакцией. У людей с таким заболеванием ß-клетки островков Лангерганса разрушены и не могут покрыть потребность организма в гормоне.
- Панкреатит. Воспаление поджелудочной железы приводит к нарушению секреторной функции и нехватке инсулина из-за фиброза тканей. Сахарный диабет, который развивается при панкреатите, называют панкреатогенным или СД 3 типа.
- Травмы, операции на поджелудочной железе. Они вызывают повреждение островкового аппарата, который продуцирует инсулин.
- Злоупотребление быстрыми углеводами. Избыточное поступление глюкозы с пищей заставляет орган работать в усиленном режиме. Со временем это приводит к нарушению инсулинарной функции из-за износа поджелудочной железы.
- Интоксикация. Алкоголь, сильнодействующие лекарства, химические и природные яды, радиоактивные вещества повреждают клетки поджелудочной железы.
- Инсулинома. Опухоль β-клеток островков поджелудочной железы приводит к избыточной секреции инсулина.
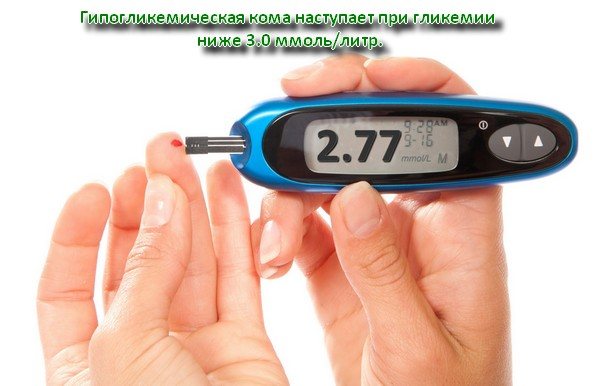
Повышенное содержание гормона опасно из-за постоянной гипогликемии. Клетки органов и тканей не могут получать достаточное количество энергии из-за низкого уровня глюкозы. Гипогликемический приступ, при котором содержание глюкозы в крови падает ниже 2,5 ммоль/л, приводит к потере сознания, локальным поражениям нервной системы, может стать причиной инфаркта миокарда. В тяжелых случаях у пациента наступает гипогликемическая кома — смертельно опасное состояние.
Нобелевская премия
В 1923г Нобелевский Комитет присудил премию в области физиологии и медицины Бантингу и Маклеоду, это произошло всего через 18 месяцев после первого доклада о препарате на собрании Ассоциации Американских Врачей (Association of American Physicians). Это решение обострило и без того непростые отношения между учеными, т.к. Бантинг считал, что вклад Маклеода в изобретение инсулина весьма преувеличен, по мнению Бантинга премия должна была быть разделена между ним и его ассистентом Бестом. Чтобы восстановить справедливость Бантинг разделил свою часть премии с Бестом, а Маклеод с биохимиком Коллипом8.
Патент на создание инсулина, принадлежавший Бантингу, Бесту и Коллипу, ученые продали за 3 доллара Университету Торонто. В августе 1922 г. было заключено соглашение о сотрудничестве с фармацевтической компанией Eli Lilly и Со, которая помогла наладить производство лекарства в промышленных масштабах.
С момента изобретения инсулина прошло уже более 90 лет. Совершенствуются препараты этого гормона, с 1982 г. пациенты получали уже человеческий инсулин, а в 90-х годах появились аналоги человеческого инсулина – препараты с различной продолжительностью действия, однако мы должны помнить о людях, стоявших у истоков создания этого препарата, ежедневно спасающего жизнь миллионам людей.
Список литературы
- IDF diabetes atlas 7th Edition. Available at: http://www.diabetesatlas.org/.
- Bliss M. The history of insulin. Diabetes Care 1993;16 Suppl 3:4-7. Available at: http://www.ncbi.nlm.nih.gov/pubmed/8299476.
- Bliss M. The discovery of insulin: the inside story. Publ. Am. Inst. Hist. Pharm. 1997;16:93-9. Available at: http://www.ncbi.nlm.nih.gov/pubmed/11619903.
- Karamitsos DT. The story of insulin discovery. Diabetes Res. Clin. Pract. 2011;93 Suppl 1:S2-8. doi:10.1016/S0168-8227(11)70007-9.
- Banting Notebook: 1920-21. Fisher Rare Book Library, University of Toronto, Toronto, Canada.
- Stylianou C, Kelnar C. The introduction of successful treatment of diabetes mellitus with insulin. J. R. Soc. Med. 2009;102(7):298-303. doi:10.1258/jrsm.2009.09k035.
- Rosenfeld L. Insulin: discovery and controversy. Clin. Chem. 2002;48(12):2270-88. Available at: http://www.ncbi.nlm.nih.gov/pubmed/12446492.
- de Herder WW. Heroes in endocrinology: Nobel Prizes. Endocr. Connect. 2014;3(3):R94-R104. doi:10.1530/EC-14-0070.
Высыпания на коже при гинекологических проблемах
Состояние детородных органов у женщины тесно зависят от гормонального фона. Многие заболевания (миома матки, киста яичника, эндометриоз) вызываются гормональным дисбалансом, в частности, соотношением андрогенов (мужских половых гормонов)и женских половых гормонов, о чём прежде всего просигнализирует специфическая сыпь на коже. Андрогены, в частности, тестостерон и ДГТ (дигидротестостерон), производятся у женщин надпочечниками и яичками. Клетки, выстилающие сальные железы кожи, имеют рецепторы андрогенов. При повышении количества гормонов рецепторы реагируют, и кожа выделяет больше сала, создавая питательную базу для бактерий. Причём ДГТ начинает производиться надпочечниками ещё до начала полового созревания, поэтому у подростков, особенно у девушек, высыпания наблюдаются уже лет с 10-12.
При поликистозе яичников у женщины падает количество женских гормонов эстрогена и прогестерона и резко возрастает уровень андрогенов. У женщины вместе с нарушением менструального цикла появляются сильные “подростковые” угри на лице и груди. В паху, подмышках и вокруг шеи заметно потемнение кожи. Также женщина отмечает повышенную волосатость ног, рук, над губой. Всё это связано с гормональным дисбалансом.
Повышение уровня женских гормонов также сказывается на состоянии кожи. Помимо прыщей на лице и теле, переизбыток эстрогена делает кожу вялой и тусклой. Она словно теряет тонус. Также отмечается снижение уровня сахара в крови и увеличение количества тромбоцитов.
Повышение прогестерона также не проходит бесследно. Кожа имеет прогестероновые рецепторы, которые реагируют на рост гормона увеличением выработки кожного сала вплоть до появления жирной себореи. Волосяная часть головы покрывается корочками, на лице и теле появляются розовые пятна, кожа на которых шелушится и отслаивается. У подростков лицо покрывается буграми, которые при надавливании выделяют жидкий сальный секрет.
У младенцев также бывает гормональная сыпь, которая может сильно напугать молодую маму. Это так называемый неонатальный цефалический пустулёз. Возникает он оттого, что малыш начинает жить отдельно от тела матери, и для него это серьёзный гормональный шок. Секреция сальных желез увеличивается, протоки закупориваются, что создаёт благоприятные условия для деятельности микробов.
Также организм новорождённого избавляется от гормонов, которые ему поставляла мама в период беременности. Помимо высыпаний на коже, у девочек набухает грудь, наблюдаются выделения из влагалища. У мальчиков отекает мошонка и пенис. Все эти симптомы проходят сами собой спустя несколько дней. Маме нужно следить, чтобы малыш не потел, чтобы на коже не размножались бактерии.
Расчет схемы лечения инсулином
Разработка схемы инсулинотерапии предполагает ограниченное во времени стационарное наблюдение больного, в течение которого прививаются знания и базовые навыки самообслуживания. Инсулинотерапия носит пожизненный характер, потому умения со временем доводятся до автоматизма, могут корректироваться зависимо от функциональных показателей организма.
В условиях медицинского стационара подбор инсулинотерапии происходит с контролем уровня гликемии, подбором доз инсулина, адекватных метаболизму, диете, физическим и эмоциональным нагрузкам. Пациенту рекомендуется ведение специального дневника, журнала, где отмечаются реально потребленные хлебные единицы углеводов, количество вводимого инсулина, степень физической активности и прецеденты возникших нарушений. Таким образом, обеспечивается систематизация полученных знаний, а совершенные ошибки подвергаются ретроспективному анализу.
Лечащий врач стремится добиться максимально возможной компенсации углеводного обмена, поскольку минимально значительные суточные колебания уровня глюкозы крови определяют наименьший риск возникновения осложнений сахарного диабета.
В применении инсулина принято реализовывать одну из двух основных тактик:
- традиционная инсулинотерапия — ежедневное введение инсулина минимальным количеством инъекций (например, дважды в день) в одинаковой дозировке; используются готовые смеси ИКД и ИСД, например, в соотношении 30:70, 2/3 суточной дозы перед завтраком, а 1/3 перед ужином; показана ограниченным группам пациентов, поскольку не обеспечивает удовлетворительное качество жизни и хорошую компенсацию заболевания, ведь потребности в инсулине могут меняться в течение дня, в то время как концентрация препаратов остается стабильной;
- интенсивная инсулинотерапия — максимально соответствует физиологической секреции гормона; состоит из двух инъекций ИСД (утром и вечером), а также инъекций ИКД перед каждым приемом пищи (рассчитывается самостоятельно пациентом зависимо от количества планируемых к употреблению углеводов и наличного уровня гликемии); требует основательного обучения пациента, но показывает превосходный результат.
Препараты инсулина принято вводить подкожно, а некоторые препараты короткого действия могут вводиться внутримышечно и внутривенно, предназначены последние больше для ургентных ситуаций и оперативных вмешательств. Скорость всасывания инсулина в кровь из места подкожного введения зависит от ряда факторов:
- тип инсулина;
- доза введенного инсулина — чем больше доза, тем медленнее всасывание и дольше действие;
- место инъекции — скорость всасывания в бедре больше, чем в плече, а в плече больше, чем в животе; в животе скорость всасывания минимальна;
- путь введения — внутримышечное введение в сравнении с подкожным отличается максимально быстрым всасыванием, но минимально короткой длительностью действия;
- скорость местного кровотока;
- местная мышечная активность — мышечная работа или массаж увеличивают скорость всасывания;
- локальная температура — скорость всасывания значительно возрастает при ее повышении.
Варианты введения инсулина
Инсулин можно вводить несколькими различными способами. Обычно решение принимается в зависимости от того, какой метод лучше всего соответствует Вашим потребностям и образу жизни. Существует множество вариантов введения, но наиболее популярны шприц-ручки с инсулином и инсулиновые помпы.
Инсулиновая помпа
Инсулиновую помпу предпочитают пациенты, не желающие делать многократные ежедневные инъекции. Она подходит как больным диабетом 1, так и 2 типа. Помпа представляет собой небольшое электронное устройство, круглосуточно вводящее инсулин ультракороткого действия в выбранной дозе для максимального удовлетворения потребностей вашего организма.
Лечение с помощью инсулиновой помпы обеспечивает множество клинических преимуществ по сравнению с лечением с помощью многократных ежедневных инъекций, например2:
- лучший контроль гликированного гемоглобина
- меньшее количество эпизодов гипогликемии
- снижение вариабельности гликемии
Шприц-ручка с инсулином
Шприц-ручка с инсулином — наиболее распространенная форма введения инсулина для больных диабетом 1 типа и некоторых больных диабетом 2 типа. Обычно в шприц-ручках используются тонкие и короткие сменные иглы, инъекции с помощью которых зачастую безболезненные. Шприц-ручка с инсулином — выбор больных диабетом, которые используют базально-болюсный режим или вводят фиксированные дозы инсулина. Для настройки дозы вводимого инсулина применяется селектор дозы в верхней части ручки.
Превращение инсулина в организме
При выходе в русло крови часть И. образует комплексы с белками плазмы крови — так наз. связанный инсулин, другая часть остается в форме свободного инсулина. Л. К. Старосельцева и сотр. (1972) установили, что существуют две формы связанного И.: одна форма — комплекс И. с трансферрином, другая — комплекс И. с одним из компонентов альфа-глобулинов сыворотки крови. Свободный и связанный И. отличны друг от друга по биол., иммунным и физ.-хим. свойствам, а также по влиянию на жировую и мышечную ткани, которые являются органами-мишенями и называются инсулинчувствительным и тканями. Свободный И. реагирует с антителами к кристаллическому П., стимулирует поглощение глюкозы мышечной и в какой-то степени жировой тканью. Связанный И. не реагирует с антителами к кристаллическому П., стимулирует поглощение глюкозы жировой тканью и практически не влияет на этот процесс в мышечной ткани. Связанный И. отличается от свободного скоростью метаболизма, поведением в электрофоретическом поле, при гельфильтрации и диализе.
При экстракции сыворотки крови солянокислым этанолом было получено вещество, по биол, эффектам подобное И. Однако это вещество не реагировало с антителами, полученными к кристаллическому Инсулину, и поэтому было названо «неподавляемая инсулиноподобная активность плазмы», или «инсулиноподобное вещество». Изучению инсулиноподобной активности придается большое значение; «неподавляемая инсулиноподобная активность плазмы» многими авторами рассматривается как одна из форм И. Благодаря процессам связывания И. с белками сыворотки крови обеспечивается его доставка к тканям. Кроме того, связанный И. является как бы формой хранения гормона в крови и создает резерв активного И. в русле крови. Определенное соотношение свободного и связанного И. обеспечивает нормальную жизнедеятельность организма.
Количество И., циркулирующего в русле крови, определяется не только скоростью секреции, но и скоростью его метаболизма в периферических тканях и органах. Наиболее активно процессы метаболизма И. протекают в печени. Существует несколько предположений о механизме этих процессов в печени; установлено, что имеются два этапа — восстановление дисульфидных мостиков в молекуле инсулина и протеолиз с образованием биологически неактивных пептидных фрагментов и аминокислот. Существует несколько инсулининактивирующих и инсулиндеградирующих ферментных систем, участвующих в метаболизме И. К ним относятся инсулининактивирующая ферментная система и инсулиндеградирующая ферментная система, к-рая представлена тремя типами протеолитических ферментов. В результате действия протеиндисульфидной редуктазы происходит восстановление — S— S-мостиков и образование А- и B-цепей И. с последующим протеолизом их до отдельных пептидов и аминокислот. Помимо печени, метаболизм И. происходит в мышечной и жировой тканях, почках, плаценте. Скорость процессов метаболизма может служить контролем за уровнем активного И. и играет большую роль в патогенезе сахарного диабета. Период биол, полураспада И. человека — ок. 30 мин.
Инсулиновая помпа
Однако наиболее современный, удобный и физиологичный метод введения инсулина – это применение инсулиновой помпы – специального устройства предназначенного для непрерывного подкожного введения инсулина.
Инсулин короткого или ультракороткого действия в этом случае вводится не с помощью инъекций шприцом или шприц-ручкой, а подается в организм посредством катетера, установленного подкожно и соединенного с резервуаром и блоком памяти, содержащим информацию о количестве инсулина, который необходимо ввести. Блок памяти программируется врачом индивидуально для каждого пациента.
У инсулиновой помпы есть два режима введения препарата: непрерывная подача инсулина в микродозах (базальная скорость) и определяемая и программируемая пациентом болюсная скорость. Первый режим имитирует фоновую секрецию инсулина и фактически заменяет применение инсулина длительного действия. Второй — болюсный — вводится пациентом перед едой или при высоком уровне гликемии, т. е. заменяет инсулин ультракороткого или короткого действия в рамках обычной инсулинотерапии. Замена катетера осуществляется пациентом через каждые 3 дня.
Сахарный диабет 2 типа — беспомощность инсулина
Сахарный диабет 2 типа (СД2) — многофакторное заболевание, в развитии которого играют роль как генетические факторы, так и образ жизни. На него приходится 90% случаев заболевания сахарным диабетом.
СД2 развивается из-за низкой чувствительности клеток к инсулину, на фоне которой нормальное количество инсулина становится недостаточным. Если сахарный диабет 1 типа начинается после гибели бета-клеток, то при сахарном диабете 2 типа клетки островков Ларгенганса продолжают функционировать, по крайней мере на момент манифестации.
Они продолжают производить инсулин, который так же поступает к клеткам, однако домофон–рецептор перестает на него реагировать. Глюкоза не может попасть в клетку и скапливается у «двери». Такое состояние называется устойчивостью к инсулину или инсулинорезистентностью.
Основная причина заболевания — ожирение. Примерно у трети людей с избыточным весом развивается сахарный диабет 2 типа. К другим факторам, которые повышают риск, относится малоподвижный образ жизни, диета с большой долей жиров и простых углеводов, скопление жировой ткани в области живота, наследственная предрасположенность, возраст.
Классические симптомы сахарного диабета 2 типа похожи на симптомы СД1 — та же хроническая усталость, жажда и обильное мочеиспускание, снижение веса, не связанное с образом жизни, помутнение зрения.
Ранние симптомы, которые также встречаются при сахарном диабете 2 типа:
- Медленное заживление ран и порезов;
- Онемение, покалывание или боль в руках и ногах;
- Кожные инфекции;
- Потемнения кожи в области подмышек, шеи и паха.
Наличие одного из этих признаков — повод обратиться к врачу.
СД2 может развиваться годами и оставаться незамеченным. Чтобы как можно раньше обнаружить признаки сахарного диабета, можно заполнять специальные опросники, а после 40 лет — проходить ежегодное скрининговое обследование.
Профилактическая проверка рекомендуется людям, у которых лишний вес сочетается с одним из следующих факторов:
- Диагноз сахарный диабет 2 типа у родственника;
- Сердечно-сосудистые заболевания в истории болезни;
- Повышенный уровень холестерина в крови;
- Высокое артериальное давление;
- Малоподвижный образ жизни;
- Гестационный диабет во время беременности или роды крупного ребенка (более 3600 г).
В отличие от сахарного диабета 1 типа, риском СД2 можно управлять. Правильное питание, нормальный вес и 150 минут упражнений в неделю снижают риск сахарного диабета 2 типа даже при генетической предрасположенности.
Рекомендуется также сократить время, проведенное в положении сидя. Если у вас сидячая работа — делайте короткие перерывы с разминкой в течение дня, а в обед можно устроить прогулку.
Сахарный диабет 2 типа нельзя полностью вылечить, можно только замедлить его развитие и контролировать осложнения. На ранних стадиях достаточно изменить образ жизни, чтобы обратить ситуацию в свою сторону. Иногда врач может назначить препараты, которые улучшают чувствительность к инсулину и откладывают развитие заболевания.
В следующей части мы подробнее расскажем, как на риск развития сахарного диабета 2 типа влияет генетика и микробиота кишечника.
Предпосылки создания инсулина
Еще в 19 веке при аутопсии пациентов, умерших от диабета, было замечено, что во всех случаях поджелудочная железа была сильно повреждена. В Германии 1869г Пауль Лангерганс открыл, что в тканях поджелудочной железы, есть определенные группы клеток, не участвующие в продукции пищеварительных ферментов.
В 1889г в Германии, физиолог Оскар Минковски и врач Джозеф фон Меринг, экспериментально доказали, что удаление поджелудочной железы у собак ведет к развитию диабета. Это позволило им предположить, что поджелудочная железа выделяет определенное вещество, отвечающее за метаболический контроль в организме2. Гипотеза Минковски и Меринга находила все новые и новые подтверждения, и уже к первому десятилетию XX века в результате изучения взаимосвязи между диабетом и повреждением островков Лангерганса поджелудочной железы, открытия эндокринной секреции, было доказано, что определенное вещество, выделяемое клетками островков Лангерганса, играет ведущую роль в регуляции углеводного обмена3. Возникла идея, что если это вещество будет выделено, то его можно будет использовать для лечения сахарного диабета, однако результаты продолжения опытов Минковски и Меркинга, когда собакам после удаления поджелудочной железы вводили ее экстракт, что в ряде случаев вело к уменьшению глюкозурии были не воспроизводимыми, а само введение экстракта вызывало повышение температуры и другие побочные эффекты.
Введение экстракта поджелудочной железы пациентам с диабетом практиковали такие европейские и американские ученые, как Георг Зульцер, Никола Паулеско4, Израиль Клейнер, однако из-за большого количества побочных эффектов и проблем, связанных с финансированием, им не удалось довести эксперименты до конца.