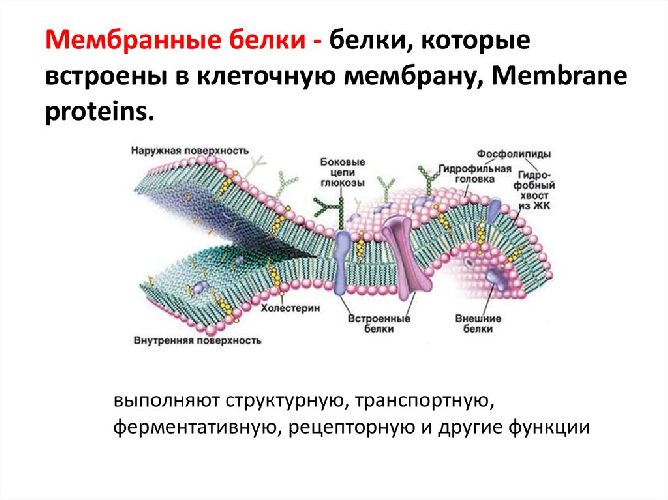
Простые и сложные белки. строение, функции, свойства, характеристика, примеры сложных белков
Содержание:
- О функциональных классах
- Белки — что это такое
- Классификация белков
- Полноценные и неполноценные белки
- Свойства белков
- Влияние простетической группы
- Полноценные и неполноценные белки
- Классификация и характеристика сложных белков
- Нуклеопротеины
- Функции хлорофилла
- Что происходит при недостатке и избытке вещества
- Ферменты, их строение и функции
- Особенности гликопротеинов и протеогликанов
- Список продуктов, содержащих белок
- Уровни организации белковых молекул
- Особенности и типы липопротеидов
- Особенности и типы липопротеидов
- Фосфопротеины
- Классификация белков
- Структура белков
- Суточная норма белка
- Классы сложных белков
О функциональных классах

Ферменты — группа белков, повышающих скорость течения химических реакций
Краткий обзор функциональных классов белков:
- ферменты — группа белков, повышающих скорость течения химических реакций. Сюда относятся, например, трипсин и пепсин;
- транспортные выполняют задачу переноса атомов, молекул, ионов как внутри клетки, так и между ними в многоклеточных организмах. Они включают, например, альбумин и гемоглобин;
- пищевые (запасные) предназначены для обеспечения полезными веществами зародышей растений и животных на начальных стадиях их развития, например, казеин и альбумин;
- сократительные (двигательные) обеспечивают клетку или организм способностью сокращаться, менять форму и передвигаться (актин и миозин);
- структурные белки формируют волокна, навитые друг на друга или уложенные плоским слоем, исполняющие опорную или защитную функцию, скрепляющие биологические структуры организмов и обеспечивающие им прочность, например, кератин и коллаген;
- защитные охраняют организм от вторжения инородных живых структур или предохраняют его от повреждений. Например, фибриноген, тромбин;
- регуляторные участвуют в клеточной или физиологической активности, например, инсулин и гормон роста.
Важно! Необходимо иметь в виду, что из-за несовершенства самой классификации белков, а также вследствие исключительного их многообразия отнесение к одной из описываемых здесь групп многих отдельных белков вызывает сложность. Белки просто незаменимы в поддержании жизни организма, а также служат его защитой
Установить, к какому классу принадлежат белки, бывает затруднительно из-за уникальности функций некоторых из них. В последнее время осуществляются попытки организовать белки в семейства и описать их домены и мотивы
Белки просто незаменимы в поддержании жизни организма, а также служат его защитой. Установить, к какому классу принадлежат белки, бывает затруднительно из-за уникальности функций некоторых из них. В последнее время осуществляются попытки организовать белки в семейства и описать их домены и мотивы.
Белки — что это такое
Все мы знаем, что данные соединения очень важны в нашей жизни. Многие ученые говорили и говорят о том, что без белков нет жизни. Они правы. Эти биополимеры крепко связаны с наследственной информацией и жизненной энергией. И все-таки дадим определение данным компонентам всех живых систем.Белки — нерегулярные, то есть непериодические биополимеры, мономерами которых являются 20 аминокислот. В их состав входят: углерод, водород, кислород, азот, иногда сера.Биополимерами называются крупные молекулы, состоящие из более простых молекул — мономеров.Как вы поняли из определения, белки являются крупными молекулами или макромолекулами и высокомолекулярными соединениями. Например, гемоглобин имеет молярную массу около 64 тыс. Молярная масса альфа-амилазы почти доходит до 100 тыс. А если брать и белки, составляющие оболочки вирусов — капсиды, то они содержат до 40 млн частиц.
Помните, что растения сами синтезируют все мономеры белков, а животные только их малую группу. Животные получают все остальные аминокислоты из органических соединений при питании.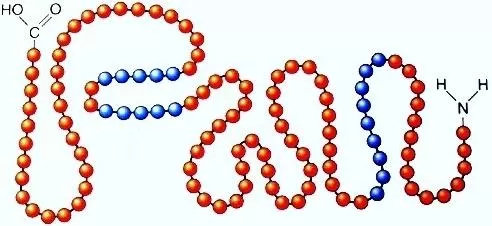
Рис. 1. Первичная структура белка
Классификация белков
Белки делятся по своему внутреннему строению:
- Фибриллярные — в строении преобладает вторичная структура. Нерастворимы в воде, обладают высокой механической прочностью. Состоят из длинных полипептидных цепочек и имеют бета-слой. Входят в состав соединительной ткани (сухожилия, костная ткань). Таковыми являются коллаген, фиброин, керотин.
- Глобулярные — в строении преобладает третичная структура. Растворимы в воде, образуют коллоиды. Выполняют ферментативную, защитную (антитела), гормональную (инсулин, глюкагон) функции. Также благодаря им вода удерживается в цитоплазме.
- Промежуточные — имеют фибриллярную структуру. Во всех моментах схожи с фибриллярными белками, но имеют одно различие — растворимость в воде.
Белки подразделяются и по сложности строения:
- Простые — состоят только из аминокислот. Таковыми являются альбумины (в крови и яичном белке) и глобулины (в крови).
- Сложные — в строении, помимо аминокислот, имеют простетическую часть. Приведем примеры сложных белков: казеин молока, муцин (в слюне), нуклеопротеины (их образуют хромосомы), липопротеины, хромопротеины (состоят из железа и гемоглобина).
Мы разобрали все самые важные моменты строения белковых молекул. Нужно остановиться на последнем вопросе — функциях белков.
Рис. 6. Функции белков
Полноценные и неполноценные белки
В процессе усвоения белков из пищи они расщепляются на аминокислоты. Затем из этих аминокислот строятся необходимые организму белки. Таким образом, для вас важен не просто белок, а состав аминокислот.
Аминокислоты делятся на незаменимые и заменимые. Заменимые способны синтезироваться в организме человека. Незаменимые, напротив, поступают только с пищей. По этой причине, при нехватке какой-либо незаменимой аминокислоты определённый белок не будет создан, что в итоге приведёт к тем или иным последствиям.
Белки, которые содержат все незаменимые аминокислоты в необходимых количествах называют полноценными.
- белки яиц;
- печень;
- молоко и молочные продукты (кроме сметаны и сливочного масла);
- рыба и морепродукты;
- мясо, птица;
- соя.
Белки, которые содержат лишь некоторые из незаменимых аминокислот называют неполноценными.
- зерновые культуры;
- бобовые (кроме сои);
- орехи и семечки;
- овощи.
Свойства белков
Примем во внимание два главных свойства:
- Денатурация — нарушение природной структуры белка при воздействии на него определенных факторов (высокой температуры, излучения, воздействия кислот, щелочей, солей). Обратимая денатурация называется ренатурацией — процесс обратим, если не разрушается первичная структура, являющаяся основной. При необратимой денатурации затрагивается первичная структура, которая восстановиться уже не может. В качестве примера такого процесса можно привести яйцо, которое на сковороде превращается в яичницу. В этом случае строение белка полностью нарушено и не восстановимо.
- Белки — органические растворители. Данные макромолекулы используются и как отличные растворители.
Обязательно стоит перейти к вопросу о классификациях белков. Разные биополимеры имеют разное строение, а также физические свойства.
Рис. 5. Четвертичная структура белка
Влияние простетической группы
Простетическая группа, входящая в состав сложных белков, влияет на его свойства: изменяет его заряд, растворимость, термопластичность. Например, таким действием обладают остатки фосфорной кислоты или моносахаридов. Углеводная часть, включенная в состав сложного белка, защищает его от протеолиза (разрушения в результате процесса гидролиза), влияет на проникновение молекул через клеточную мембрану, их секрецию и сортировку. Липидный фрагмент позволяет создавать белковые каналы для транспорта плохо растворимых в воде (гидрофобных) соединений.
Строение и функции сложных белков полностью зависят от простетической группы. Например, с помощью железосодержащего гема в гемоглобине происходит связывание кислорода и углекислого газа. За счет нуклеопротеидов, формируемых в результате взаимодействия гистонов, протаминов с ДНК или РНК, происходит защита генетического материала, его компактное хранение, связывание РНК в процессе синтеза белков. Нуклеопротеидами называют устойчивые комплексы белков и нуклеиновых кислот.
Полноценные и неполноценные белки
Белки, поступающие в организм с пищей, разделяются на биологически полноценные и биологически неполноценные.
Биологически полноценными называются те белки, в которых в достаточном количестве содержатся все аминокислоты, необходимые для синтеза белка животного организма. В состав полноценных белков, необходимых для роста организма, входят следующие незаменимые аминокислоты: лизин, триптофан, треонин, лейцин, изолейцин, гистидин, аргинин, валин, метионин, фенилаланин. Из этих аминокислот могут образоваться другие аминокислоты, гормоны и т. д. Из фенилаланина образуется тирозин, из тирозина путем превращений — гормоны тироксин и адреналин, из гистидина — гистамин. Метионин участвует в образовании гормонов щитовидной железы и необходим для образования холина, цистеина и глютатиона. Он необходим для окислительно-восстановительных процессов, азотистого обмена, усвоения жиров, нормальной деятельности головного мозга. Лизин участвует в кроветворении, способствует росту организма. Триптофан также необходим для роста, участвует в образовании серотонина, витамина РР, в тканевом синтезе. Лизин, цистин и валин возбуждают сердечную деятельность. Малое содержание цистина в пище задерживает рост волос, увеличивает содержание сахара в крови.
Биологические неполноценными называются те белки, в которых отсутствуют хотя бы даже одна аминокислота, которая не может быть синтезирована животными организмами.
Биологическая ценность белка измеряется количеством белка организма, которое образуется из 100 г белка пищи.
Белки животного происхождения, содержаться в мясе, яйцах и молоке, наиболее полоненные (70-95%). Белки растительного происхождения имеют меньшую биологическую ценность, например белки ржаного хлеба, кукурузы (60%), картофеля, дрожжей (67%).
Белок животного происхождения – желатина, в котором нет триптофана и тирозина, является неполноценным. В пшенице и ячмене мало лизина, в кукурузе мало лизина и триптофана.
Некоторые аминокислоты заменяют друг друга, например фенилаланин заменяет тирозин.
Два неполноценных белка, в которых недостает разлчных аминокислот, вместе могут составить полноценное белковое питание.
Классификация и характеристика сложных белков
Эти вещества делятся на виды в зависимости от типа дополнительной группы. К сложным белкам относятся:
- Гликопротеины – белки, молекулы которых содержат углеводный остаток. Среди них выделяют протеогликаны (компоненты межклеточного пространства), включающие в свою структуру мукополисахариды. К гликопротеидам относятся иммуноглобулины.
- Липопротеиды включают липидный компонент. К ним относятся аполипопротеины, выполняющие функцию обеспечения липидного транспорта.
- Металлопротеины содержат ионы металлов (меди, марганца, железа и др.), связанные через донорно-акцепторное взаимодействие. В эту группу не входят гемовые белки, включающие соединения профиринового кольца с железом и подобные им по структуре соединения (хлорофилл, в частности).
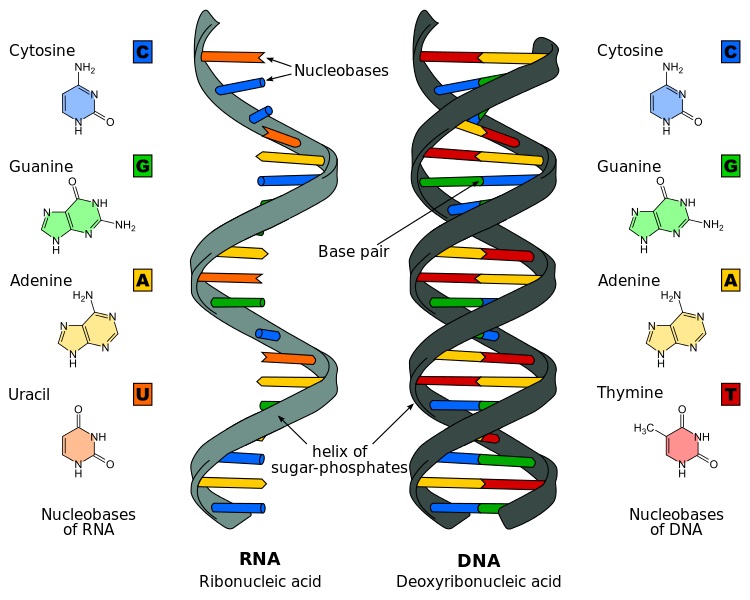
- Нуклеопротеиды – белки, имеющие нековалентные связи с нуклеиновыми кислотами (ДНК, РНК). К ним относится хроматин – компонент хромосом.
- 5. Фосфопротеиды, к которым относится казеин (сложный белок творога), включают ковалентно соединенные остатки фосфорной кислоты.
Хромопротеины объединяет окрашенность простетического компонента. Данный класс включает гемовые белки, хлорофиллы и флавопротеиды.
Нуклеопротеины
Нуклеопротеины – белки, соединенные с нуклеиновыми кислотами. Они – неотъемлемая часть хранения и регуляции генетического материала, работы рибосом, выполняющих функцию синтеза белка. Самые простейшие формы жизни вирусов можно назвать рибо- и дезоксирибонуклеопротеинами, так как они состоят из генетического материала и белков.
Как происходит взаимодействие дезоксирибонуклеиновой кислоты (ДНК) и гистонов? В хроматине выделяют 2 вида белков, связанных с ДНК (гистоновые и негистоновые). Первые участвуют на начальной стадии компактизации ДНК. Молекула нуклеиновой кислоты обвивается вокруг протеинов с формированием нуклеосом. Образовавшаяся нить похожа на бусины, из них формируются суперспирализованная структура (хроматиновая фибрилла) и суперспираль (хромонема интерфазы). За счет действия гистоновых белков и протеинов более высоких уровней обеспечивается сокращением размерности ДНК в тысячи раз
Достаточно сравнить размер хромосом и длину нуклеиновой кислоты, чтобы оценить важность белков (6-9 см и 10-6 мкм, соответственно)
Функции хлорофилла
Как мы уже упоминали ранее, сложные белки могут образовывать комплексы с пигментами – окрашенными органическими веществами. Их цвет зависит от хромоформных групп, которые избирательно поглощают определённые спектры солнечного света. В клетках растений есть зеленые пластиды – хлоропласты, содержащие пигмент хлорофилл. В его состав входят атомы магния и многоатомный спирт фитол. Они связаны с белковыми молекулами, а сами хлоропласты содержат тилакоиды (пластинки), или мембраны, связанные в стопки – граны. В них находятся фотосинтезирующие пигменты – хлорофиллы — и дополнительные каротиноиды. Здесь же находятся все ферменты, используемые в фотосинтетических реакциях. Таким образом, хромопротеиды, к которым относится и хлорофилл, выполняют важнейшие функции в обмене веществ, а именно в реакциях ассимиляции и диссимиляции.
Что происходит при недостатке и избытке вещества
- Суточная потребность для взрослого рассчитывается из соотношения 1-1,5 г чистого белка на 1 кг веса, что среднем составляет 80-100 г, 30 г из них лучше получить из продуктов животного происхождения. Если предполагаются большие физические нагрузки, то эту норму увеличивают.
- Для младенцев норма за сутки составляет 2,2 г на 1 кг.
- Дети 7-10 лет должны ежедневно получать 36 г.
- А для беременных к дозировке взрослого человека дополнительно прибавляется еще 30 г для питания будущего ребенка.
Вышеперечисленные нормы действуют при соблюдении следующих правил:
- Правильное соотношение растительной и животной пищи.
- Полноценный аминокислотный состав.
- Наличие в рационе дополнительных углеводов и жиров.
Недостаток протеинов в рационе можно определить даже на глаз. Нехватка приводит:
- к дряблости кожи и появлению мелких морщинок.
- потере мышечной массы и обвисанию мышц на теле.
- ухудшению состояния кожи, волос и ногтей.
- проблемам с функционированием ЖКТ и ожирению.
- снижению стрессоустойчивости и быстрому утомлению.
Анализ крови при существенном дефиците белка показывает недостаток гемоглобина и иммуноглобулина.
Избыток этого вещества тоже вреден. Чрезмерное потребление плохо воздействует на почки. Оно может стать причиной остеопороза: для усвоения протеинов требуется кальций, а при недостатке минерала в пище он будет извлекаться из костей. Кроме того, злоупотребление увеличивает риск развития атеросклероза.
Ферменты, их строение и функции
Это большая группа белков (около 2000), выполняющих роль веществ, влияющих на скорость протекания биохимических реакций в клетках. Они могут быть простыми (трепсин, пепсин) или сложными. Сложные белки состоят из кофермента и апофермента. Специфичность самого белка относительно соединений, на которые он воздействует, определяет кофермент, а активность протеидов наблюдается только в том случае, когда белковый компонент связан с апоферментом. Каталитическая активность фермента зависит не от всей молекулы, а только от активного центра. Его строение соответствует химической структуре катализируемого вещества по принципу «ключ-замок», поэтому действие ферментов строго специфично. Функции сложных белков заключаются как в участии в метаболических процессах, так и в использовании их в качестве акцепторов.
Особенности гликопротеинов и протеогликанов
Эти белки являются сложными веществами. Протеогликаны содержат большую долю углеводов (80-85%), у обычных гликопротеидов содержание составляет 15-20%. Уроновые кислоты присутствуют только в молекуле протеогликанов, их углеводы отличаются регулярным строением с повторяющимися звеньями. Какова структура и функции сложных белков гликопротеинов? Их углеводные цепи включают только 15 звеньев и имеют нерегулярное строение. В структуре гликопротеинов связь углевода с белковым компонентом обычно осуществляется через остатки таких аминокислот, как серин или аспаргин.
Функции гликопротеинов:
- Входят в состав клеточной стенки бактерий, костной соединительной и хрящевой ткани, окружают волокна коллагена, эластина.
- Играют защитную роль. Например, данную структуру имеют антитела, интерфероны, факторы свертываемости крови (протромбин, фибриноген).
- Являются рецепторами, которые взаимодействуют с эффектором – небольшой небелковой молекулой. Последняя, присоединяясь к белку, приводит к изменению его конформации, что приводит к определенному внутриклеточному ответу.
- Выполняют гормональную функцию. К гликопротеинам относится гонадотропный, адренокортикотропный и тиреотропный гормоны.
- Транспортируют вещества в крови и ионы через клеточную мембрану (трансферрин, транскортин, альбумин, Na+ ,К+ -АТФаза).
К гликопротеиновым ферментам относятся холинэстераза и нуклеаза.
Список продуктов, содержащих белок
|
Продукт питания |
Белки (г.) в 100 г продукта |
|
Морепродукты |
|
| Икра красная | 31,6 |
| Горбуша | 23 |
| Лосось | 20 |
| Палтус | 20 |
| Креветки | 18,7 |
| Окунь | 18,5 |
| Сайра в масле | 18,4 |
| Сельдь | 18 |
| Кальмар | 18 |
| Навага, треска | 17,8 |
| Минтай | 17,7 |
| Камбала | 17,5 |
| Шпроты (консервы) | 17,3 |
| Осетр | 15,8 |
|
Мясные продукты |
|
| Курица отварная | 25 |
| Куриная грудка | 23 |
| Куриная печень | 22 |
| Курица | 20,5 |
| Говядина | 21 |
| Говядина | 21 |
| Свинина | 20,5 |
| Печень свиная | 20,2 |
| Баранина | 20 |
| Печень говяжья | 19,8 |
| Говядина тушёная | 16,7 |
| Свинина тушёная | 15 |
|
Яйца |
|
| Яйцо куриное | 12,9 |
| Яйцо перепелиное | 11,9 |
|
Молочные продукты |
|
| Сыр пармезан | 35 |
| Сыр голландский | 26 |
| Молоко сухое цельное | 25 |
| Сыр российский | 23 |
| Творог нежирный | 18 |
| Творог жирный | 14 |
| Сыр плавленый | 12 |
| Молоко сгущённое с сахаром | 7,2 |
| Йогурт | 3-4,5 |
| Кефир | 3,3 |
| Молоко цельное | 3,3 |
| Молоко пастеризованное | 3 |
| Сметана 10% жирности | 3 |
| Сливки 10% жирности | 3 |
| Сливки 20% жирности | 2,8 |
| Сметана 20% жирности | 2,8 |
|
Орехи и бобовые |
|
| Соевая мука | 37 |
| Соя | 36 |
| Арахис | 26,2 |
| Тыквенные семечки | 24 |
| Чечевица | 23,5 |
| Семена подсолнечника | 22,5 |
| Фасоль | 21 |
| Горох | 21 |
| Фисташки | 20 |
| Нут | 20 |
| Миндаль | 18,8 |
| Кешью | 18,5 |
| Грецкий орех | 16,2 |
| Фундук | 15 |
| Бразильский орех | 14,3 |
| Кедровый орех | 13,8 |
| Пекан | 9,2 |
|
Зерновые |
|
| Пшеничные отруби | 15 |
| Овсяная мука | 14 |
| Геркулес | 13 |
| Кускус | 13 |
| Гречневая крупа | 12,5 |
| Пшеничная крупа | 12,5 |
| Булгур | 12 |
| Пшено | 12 |
| Овсяная крупа | 12 |
| Манная крупа | 11 |
| Гречневая мука | 11 |
| Мука пшеничная 1 сорта | 10,6 |
| Мука пшеничная высшего сорта | 10 |
| Ячневая крупа | 10 |
| Перловая крупа | 9 |
| Кукуруза (цельные зерна) | 8,5 |
| Кукурузная мука | 8 |
| Хлеб ржаной зерновой | 8,5 |
| Пшеничный хлеб (белый) | 7,6 |
| Рис бурый | 7,5 |
| Рис белый | 7 |
| Рис белый отварной | 2 |
|
Овощи |
|
| Горошек зеленый | 5 |
| Капуста брюссельская | 4,5 |
| Кресс-салат | 4,2 |
| Брокколи | 3 |
| Шпинат | 2,8 |
| Капуста цветная | 2,5 |
Уровни организации белковых молекул
Они представлены четырьмя различными конфигурациями. Первая структура — линейная, она наиболее проста и имеет вид полипептидной цепи, во время её спирализации происходит образование дополнительных водородных связей. Они стабилизируют спираль, которая называется вторичной структурой. Третичный уровень организации имеют простые и сложные белки, большинство растительных и животных клеток. Последняя конфигурация — четвертичная, возникает при взаимодействии нескольких молекул нативной структуры, объединенных коферментами, именно такое строение имеют сложные белки, выполняющие в организме разнообразные функции.
Особенности и типы липопротеидов
Сложный белок липопротеид отличается хорошо выраженной двойственной гидрофильной и гидрофобной природой. Ядро молекулы (гидрофобную часть) образуют неполярные эфиры холестерола и триацилглицериды.
Снаружи в гидрофильной зоне располагаются белковая часть, фосфолипиды, холестерол. Выделяют несколько разновидностей белков липопротеидов в зависимости от их структуры.
Основные классы липопротеидов:
- Сложный белок высокой плотности (ЛВП, α-липопротеины). Перемещает холестерин к печени и периферическим тканям.
- Низкой плотности (ЛНП, β-липопротеины). Кроме холестерина транспортируют триацилглицериды и фосфолипиды.
- Очень низкой плотности (ЛОНП, пре-β-липопротеины). Выполняют функцию, подобную ЛНП.
- Хиломикроны (ХМ). Транспортируют жирные кислоты и холестерин из кишечника после поступления пищи.
Такая сосудистая патология, как атеросклероз, возникает в результате неправильного соотношения разных типов липопротеинов в крови. По характеристике состава можно выявить несколько тенденций изменения структуры фосфолипидов (от ЛВП до хиломикронов): уменьшение доли белка (от 80 до 10%) и фосфолипидов, увеличение процента триацилглицеридов (от 20 до 90%).
Особенности и типы липопротеидов
Сложный белок липопротеид отличается хорошо выраженной двойственной гидрофильной и гидрофобной природой. Ядро молекулы (гидрофобную часть) образуют неполярные эфиры холестерола и триацилглицериды.
Снаружи в гидрофильной зоне располагаются белковая часть, фосфолипиды, холестерол. Выделяют несколько разновидностей белков липопротеидов в зависимости от их структуры.
Основные классы липопротеидов:
- Сложный белок высокой плотности (ЛВП, α-липопротеины). Перемещает холестерин к печени и периферическим тканям.
- Низкой плотности (ЛНП, β-липопротеины). Кроме холестерина транспортируют триацилглицериды и фосфолипиды.
- Очень низкой плотности (ЛОНП, пре-β-липопротеины). Выполняют функцию, подобную ЛНП.
- Хиломикроны (ХМ). Транспортируют жирные кислоты и холестерин из кишечника после поступления пищи.
Такая сосудистая патология, как атеросклероз, возникает в результате неправильного соотношения разных типов липопротеинов в крови. По характеристике состава можно выявить несколько тенденций изменения структуры фосфолипидов (от ЛВП до хиломикронов): уменьшение доли белка (от 80 до 10%) и фосфолипидов, увеличение процента триацилглицеридов (от 20 до 90%).
Фосфопротеины
Что входит в состав сложных белков фосфопротеинов? Для данной категории характерно присутствие фосфатной группы, которая связана с белковой частью через аминокислоты с гидроксилом (тирозин, серин или треонин). Какие функции выполняет фосфорная кислота, находясь в структуре белка? Она изменяет структуру молекулы, придает ей заряд, повышает растворимость, влияет на свойства белка. Примерами фосфопротеинов являются казеин молока и яичный альбумин, но в основном к данной категории сложных белков относятся ферменты.
Фосфатная группа играет важную функциональную роль, так как многие белки связаны с ней не постоянно. В клетке все время происходят процессы фосфорилирования и дефосфорилирования. В результате выполняется регуляция в работе белков. Например, если гистоны – белки, соединенные с нуклеиновыми кислотами переходят в фосфорилированное состояние, то активность генома (генетического материала) возрастает. От фосфорилирования зависит активность таких ферментов, как гликогенсинтаза и гликогенфосфорилаза.
Классификация белков
Классификация белков варьируется в зависимости от основного фактора, принятого во внимание
Классификация композиции
Когда объектом исследования является состав белков, их можно разделить на две группы:
- Простые белки : это те, которые при гидролизе выделяют только аминокислоты.
- Конъюгированные белки представляют собой белки, которые во время гидролиза выделяют аминокислоты и непептидный радикал.
Классификация по количеству полипептидных цепей
Что касается количества полипептидных цепей, белки могут быть классифицированы как:
- Мономерные белки : это белки, которые имеют только полипептидную цепь.
- Олигомерные белки : белки, образованные более чем одной полипептидной цепью.
Классификация по форме
Что касается формы, белки можно классифицировать на два типа:
- Волокнистые белки: в волокнистых белках полипептидные цепи свертываются как веревка. Одной из характеристик волокнистых белков является то, что они не растворимы в водных растворах. Кроме того, они несут ответственность за прочность и гибкость конструкций, в которых они присутствуют. Примеры волокнистых белков : кератин, коллаген
- Глобулярные белки: полипептидные цепи глобулярных белков изгибаются приблизительно в сферическую или глобулярную форму, делая их похожими на глобус. Глобулярные белки обычно растворимы в водных растворах. Примеры глобулярных белков : гемоглобин, ферменты.
Изображения волокнистого белка и глобулярного белка
Узнайте больше о гемоглобине и ферменте.
Структура белков
Что касается структуры молекулы белка, посмотрите, как ее можно классифицировать:
Первичная структура
Первичная структура определяется генетически. Это самая простая структура, где аминокислоты расположены линейно.
Вторичная структура
Для того чтобы структура белка была вторичной, первичная структура должна иметь ковалентно связанные аминокислоты. Таким образом, молекулы могут подвергаться вращению и, наконец, самостоятельно взаимодействовать тремя способами:
- Альфа-спираль : спиральная форма имеет место, когда возникают водородные связи между аминокислотами.
- Бета-листы : когда возникают водородные связи между аминокислотами и последующим образованием листа и жесткой структуры.
- Связи : являются нерегулярными структурами в ядре, и их образование происходит вне сворачивания белка.
Четвертичная структура
Эта структура имеет место посредством взаимодействия между одинаковыми или нет полипептидными цепями, которые группируются и образуют уникальную трехмерную структуру.
Суточная норма белка
Все вы непрерывно нуждаетесь в аминокислотах. Они выполняют свою функцию и распадаются. Часть попадает в кровь и используется вновь, другая часть – утилизируется.
Белки жизненно необходимы. Поэтому каждый взрослый человек должен употреблять минимум 40–50 г белка в сутки.
На самом деле 40–50 г – минимальная норма потребления, которая необходима для вашей жизни.
Ваша потребность зависит от калорийности. Калорийность, в свою очередь, зависит от пола, веса, возраста, физической активности. Рассчитав вашу индивидуальную калорийность и учитывая, что 1 г белка имеет калорийность 4 ккал и рассчитывается ваша норма. Поэтому говорить, что каждому человеку нужно 1, — 1,5 или 2 г белка на 1 кг веса в день — неверно.
Приблизительная норма на день приведена в таблице ниже в граммах.
Для примера были проведены расчёты для мужчины и женщины 30 лет, среднего роста с низкой активностью.
В случае с набором веса взята средняя активность (3 тренировки в неделю).
В зависимости от вашего веса и пола вы можете взять данные из таблицы за основу своего рациона. Повторяюсь, цифра примерная. Подобные расчёты проводятся по определённым формулам, согласно вашему возрасту, росту, весу, активности и ваших целей.
| 50 -55 кг | 55-60 кг | 60-65 кг | 65-70 кг | 75-80 кг | 80-85 кг | |
| Мужчины | ||||||
| Похудение | 145 | 150 | 155 | 160 | 165 | 170 |
| Поддержание веса | 136 | 141 | 145 | 150 | 155 | 160 |
| Набор мышечной массы | 200 | 210 | 220 | 230 | 240 | 250 |
| Женщины | ||||||
| Похудение | 122 | 127 | 132 | 137 | 142 | 147 |
| Поддержание веса | 116 | 120 | 124 | 128 | 132 | 136 |
| Набор мышечной массы | 170 | 177 | 184 | 191 | 198 | 205 |
Здесь имеется в виду не только животный, но и растительный белок. А значит учитывайте не только мясо, яйца, но и хлеб, молочные продукты, крупы, овощи, фрукты и т. д. Поэтому какими бы ни были ваши цели, скорее всего, вам не придётся прилагать огромных усилий для того, чтобы достичь своей нормы.
Когда потребность в белках возрастает
- При увеличении физической нагрузки (тяжёлая работа, тренировки для увеличения мышечной массы и т. д.).
- Во время болезни, и в период выздоровления, а также во время стрессов.
- Во время интенсивного роста и развития.
- При беременности и грудном вскармливании.
- В холодное время года.
Признаки нехватки белка
- Усталость, слабость, утомляемость.
- Снижение объёма мускулатуры.
- Задержка роста у детей.
- Сухая, дряблая кожа.
- Сухие, тусклые, ломкие волосы.
- Снижение сопротивляемости к различным инфекциям.
- Анемия.
- Отёки.
- Нарушение функций систем организма: сердечно-сосудистой, нервной, кровеносной, ЖКТ и т. д.
Причины дефицита
- Нехватка белка в пище.
- Несбалансированность рациона из-за питания только растительной пищей, голодания или вегетарианства. Вы можете есть белковые продукты, но при этом не получать весь комплекс необходимых аминокислот.
- Заболевания ЖКТ.
- Нарушение всасывания.
- Дефицит гормонов.
Избыток белка в организме
Хроническое употребление большого количества белка может вызывать:
- желудочно-кишечные, почечные и сосудистые нарушения;
- снижение естественного иммунитета, что приводит к инфекционным болезням;
- фактор риска возникновения онкологии.
Классы сложных белков
Они были разработаны биохимиками, исходя из 3 критериев: физико-химических свойств, функциональных особенностей и специфики структурных признаков протеидов. К первой группе относятся полипептиды, различающиеся электрохимическими свойствами. Они делятся на основные, нейтральные и кислые. По отношению к воде белки могут быть гидрофильными, амфифильными и гидрофобными. Ко второй группе относятся ферменты, которые были рассмотрены нами ранее. Третья группа включает полипептиды, различающиеся химическим составом простетических групп (это хромопротеиды, нуклеопротеиды, металлопротеиды).
Рассмотрим свойства сложных белков более подробно. Так, например, кислый белок, входящий в состав рибосом, содержит 120 аминокислот и является универсальным. Он находится в белоксинтезирующих органеллах, как прокариотических, так и эукариотических клеток. Еще один представитель этой группы — белок S-100, состоит из двух цепей, связанных ионом кальция. Он входит в состав нейронов и нейроглии — опорной ткани нервной системы. Общее свойство всех кислых белков — это высокое содержание двухосновных карбоновых кислот: глутаминовой и аспарагиновой. К щелочным белкам относятся гистоны — протеины, входящие в состав нуклеиновых кислот ДНК и РНК. Особенностью их химического состава является большое количество лизина и аргинина. Гистоны вместе с хроматином ядра образуют хромосомы — важнейшие структуры наследственности клеток. Эти белки участвуют в процессах транскрипции и трансляции. Амфифильные протеины широко представлены в клеточных мембранах, образуя липопротеиновый бислой. Таким образом, изучив выше рассмотренные группы сложных белков, мы убедились в том, что их физико-химические свойства обусловлены строением белкового компонента и простетических групп.
Некоторые сложные белки клеточных мембран способны узнавать различные химические соединения, например антигены, и реагировать на них. Это сигнальная функция протеидов, она очень важна для процессов избирательного поглощения веществ, поступающих из внешней среды, и для её защиты.