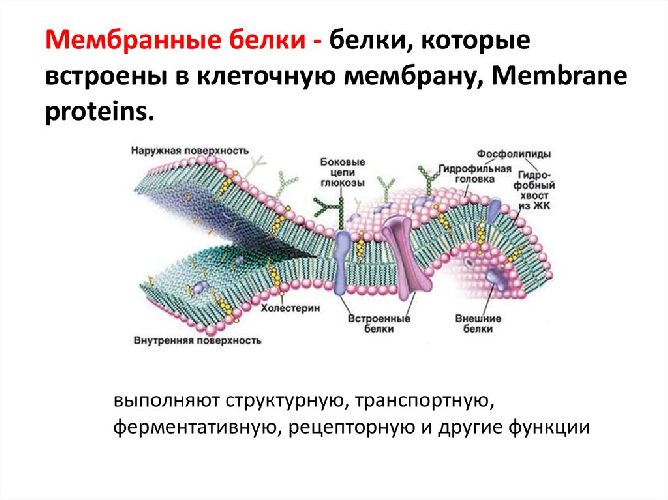
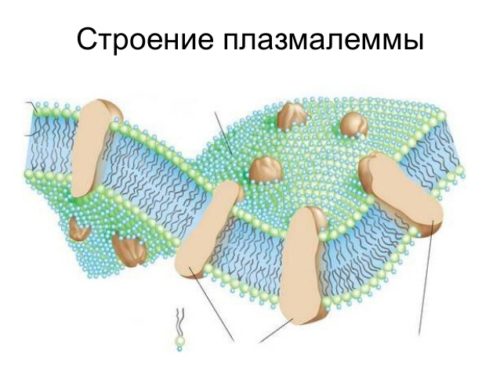
Какие функции белков в клетке?
Содержание:
Функции белков в клетке:
- Строительная – обусловлена наличием белка во всех клеточных структурах. (Форма всех органелл клетки зависит от структуры белков).
- Каталитическая – реакции в клетке без ферментов идут медленно, так как концентрации исходных веществ (субстратов) в клетке малы. Обычно размеры молекул ферментов больше, чем размеры субстратов. Например, молекулярная масса каталазы, разрушающей пероксид водорода Н2О2, равна 250000, а самого пероксида – 34. Активный центр фермента – лишь небольшой участок его молекулы, на котором и происходит сама реакция. Фермент сравнивают с замком, а субстрат – с ключом, так как они должны точно подходить друг другу. Каждая реакция катализируется своим ферментом, однако существуют ферменты, которые катализируют несколько реакций.
- Двигательная – все движения обусловлены работой двигательных (сократительных) белков. В мышечных клетках при сокращении нитей более активна внедрённая между волокнами миозина за счёт энергии АТФ.
- Транспортная – белок гемоглобин транспортирует кислород и углекислый газ в организме. Через мембраны происходит транспорт различных веществ (сахар, ионы и др.).
- Защитная – осуществляется с помощью антител и антигенов. Антитела – белковые структуры β-лимфоцитов избирательно связывающиеся с чужеродными белками и клетками. Антигены – белки на поверхности клетки или в растворе, по которым Т-лимфоциты различают свои клетки и чужеродные. Убитые или ослабленные бактерии и вирусы (вакцины) несут свои антигены. При введении их в организм иммунная система вырабатывает антитела, что препятствует заболеванию.
- Энергетическая – белки являются источниками энергии. 1г белка при окислении даёт 17,6 кДж. Белок при разрушении образует СО2, Н2О, NH3. Аммиак NH3 ядовит, поэтому в печени он превращается в мочевину и мочевую кислоту.
- Регуляторная – пептидные гормоны, выделяемые железами внутренней секреции, изменяют обмен веществ в клетках определенных тканей.
Инсулин активирует захват молекулы глюкозы клеткой и синтез из неё гликогена. Без инсулина клетки голодают, так как не поглощают глюкозу, в результате чего развивается сахарный диабет. Т-лимфоциты передают с помощью белков информацию о чужеродных клетках β-лимфоцитам.
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Свойства белков так же разнообразны, как и функции. Одни растворяются в воде и образуют коллоидные растворы, другие растворяются в разбавленных растворах солей. Некоторые нерастворимы, например, белки кожи.
ХИМИЧЕСКИЕ СВОЙСТВА
В радикалах АК-остатков белков содержатся различные функциональные группы, способные вступать в химические реакции:
- восстановления;
- этерификации;
- лкилирования;
- нитрования.
Будучи амфотерным соединением белок реагирует и с кислотами, и со щелочами.
Структура и функции
Домены
Большинство молекул миозина состоит из области головы , шеи и хвоста.
- Домен головки связывает нитчатые актин и использует АТФ гидролиза для создания силы и «ходить» вдоль нити к колючей (+) конца (за исключением миозина VI, который движется в направлении заостренного (-) конца).
- домен шеи выступает в качестве линкера и в качестве рычага для преобразовательной силы , генерируемой с помощью каталитического домена двигателя. Горловой домен также может служить сайтом связывания для легких цепей миозина, которые представляют собой отдельные белки, которые образуют часть макромолекулярного комплекса и обычно выполняют регуляторные функции.
- Домен хвоста как правило , опосредует взаимодействие с молекулами грузовых и / или другими миозином субъединицами . В некоторых случаях хвостовой домен может играть роль в регуляции двигательной активности.
Рабочий ход
Множественные молекулы миозина II генерируют силу в скелетных мышцах посредством механизма силового удара, подпитываемого энергией, высвобождаемой при гидролизе АТФ. Силовой удар происходит при высвобождении фосфата из молекулы миозина после гидролиза АТФ, в то время как миозин прочно связан с актином. Эффект этого высвобождения — конформационное изменение молекулы, которая противодействует актину. Высвобождение молекулы АДФ приводит к так называемому состоянию окоченения миозина. Связывание новой молекулы АТФ высвобождает миозин из актина. Гидролиз АТФ внутри миозина заставит его снова связываться с актином, чтобы повторить цикл. Комбинированный эффект бесчисленных силовых ударов заставляет мышцу сокращаться.
Генетика
Клонирование кДНК MYBPC3 человека и локализация гена на хромосоме 11p11.2 человека способствовали структуре и функции cMyBP-C. Таким образом, MYBPC3 стал «лучшим» геном-кандидатом в локус CMH4 для гипертрофической кардиомиопатии, который первоначально был картирован группой Шварца. Были идентифицированы мутации MYBPC3, сегрегированные в семьях с гипертрофической кардиомиопатией . MYBPC3 , таким образом , был четвертый ген гипертрофической кардиомиопатии , после MYH7 , кодирующий β- тяжелой цепи миозина , TNNT2 и TPM1 , кодирующий сердечной тропонина Т и α- тропомиозин , соответственно, выделяя гипертрофической кардиомиопатии , как болезнь саркомера .
На сегодняшний день идентифицировано около 350 мутаций в MYBPC3 , и в значительной степени мутации приводят к усечению белка, сдвигам в рамках считывания и кодонам преждевременной терминации. Генетические исследования выявили значительное совпадение генотипов и фенотипов, поскольку мутации MYBPC3 могут приводить к различным формам кардиомиопатий, таким как дилатационная кардиомиопатия и некомпактная кардиомиопатия левого желудочка . У пациентов с изолированными или семейными случаями дилатационной кардиомиопатии мутации MYBPC3 представляли собой второе по величине количество известных мутаций. Кроме того, интронная делеция MYBPC3 длиной 25 пар оснований, приводящая к усечению белка, присутствует у 4% населения Южной Индии и связана с более высоким риском развития сердечной недостаточности. Мутации основателя MYBPC3 были зарегистрированы в Исландии, Италии, Нидерландах, Японии, Франции и Финляндии, где они составляют большой процент случаев гипертрофической кардиомиопатии. Все они являются усекающими мутациями, приводящими к более короткому белку, лишенному регуляторного фосфорилируемого М-мотива и / или основных связывающих доменов с другими саркомерными белками. Совокупность доказательств указывает на то, что пациенты с более чем одной мутацией часто развивают более тяжелый фенотип, и значительная часть гипертрофической кардиомиопатии с началом в детстве (14%) вызвана сложными генетическими вариантами. Это говорит о том, что эффект дозировки гена может быть ответственным за проявления в более молодом возрасте. Сообщалось в общей сложности о 51 случае гомозигот или сложных гетерозигот, большинство из них с двойным усечением мутаций MYBPC3 и связано с тяжелой кардиомиопатией, приводящей к сердечной недостаточности и смерти в течение первого года жизни.
Парамиозин
Парамиозин — это большой мышечный белок , 93–115 кДа , который был описан в ряде различных типов беспозвоночных . Считается, что толстые нити беспозвоночных состоят из внутреннего парамиозинового ядра, окруженного миозином. Миозин взаимодействует с актином , что приводит к сокращению волокон. Парамиозин обнаружен у многих различных видов беспозвоночных, например у Brachiopoda , Sipunculidea , Nematoda , Annelida , Mollusca , Arachnida и Insecta . Парамиозин отвечает за механизм «захвата», который обеспечивает устойчивое сокращение мышц с очень небольшими затратами энергии, так что моллюск может оставаться закрытым в течение длительного времени.
Состав
cMyBP-C представляет собой белок 140,5 кДа, состоящий из 1273 аминокислот. cMyBP-C — это миозин-ассоциированный белок, который связывается с интервалами 43 нм вдоль основной цепи толстой миозиновой нити, растягиваясь на 200 нм по обе стороны от M-линии в зоне, несущей поперечный мостик (C-область) полосы A в поперечно-полосатые мышцы. Приблизительная стехиометрия cMyBP-C вдоль толстой нити составляет 1 на 9-10 молекул миозина, или 37 молекул cMyBP-C на толстую нить. Помимо миозина, cMyBP-C также связывает тайтин и актин . Изоформа cMyBP-C, экспрессируемая в сердечной мышце, отличается от изоформы, экспрессируемой в медленных и быстрых скелетных мышцах ( MYBPC1 и MYBPC2 соответственно), тремя особенностями: (1) дополнительным иммуноглобулиновым (Ig) -подобным доменом на N-конце, (2 ) линкерная область между вторым и третьим доменами Ig и (3) дополнительная петля в шестом домене Ig . cMyBP-C, по-видимому, необходим для нормального порядка, длины волокон и расстояния между решетками в структуре саркомера .
Функции белков
Работа и функции белков лежат в основе структуры любого организма и всех протекающих в нем жизненных реакций. Любые нарушения этих белков приводят к изменению самочувствия и нашего здоровья. Необходимость изучения строения, свойств и видов белков кроется в многообразии их функций.
Первые слова из определения Ф.Энгельсом понятия жизни «Жизнь есть способ существования белковых тел, …. » до сих пор, по прошествии полутора веков, не потеряли своей правильности и актуальности.
Структурная функция
Вещество соединительной ткани и межклеточный матрикс формируют белки коллаген, эластин, кератин, протеогликаны.
Непосредственно участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин (интегральный, фиксирует спектрин на поверхности).
К данной функции можно отнести участие в создании органелл – рибосомы.
Ферментативная функция
Все ферменты являются белками. В то же время есть данные о существовании рибозимов, т.е. рибонуклеиновых кислот, обладающих каталитической активностью.
Гормональная функция
Регуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Такие гормоны как инсулин и глюкагон являются белками, все гормоны гипофиза являются пептидами или небольшими белками.
Рецепторная функция
Эта функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток.
Транспортная функция
Только белки осуществляют перенос веществ в крови, например, липопротеины (перенос жира), гемоглобин (связывание кислорода), гаптоглобин (транспорт гема), трансферрин (транспорт железа). Белки транспортируют в крови катионы кальция, магния, железа, меди и другие ионы.
Транспорт веществ через мембраны осуществляют белки — Na+,К+-АТФаза (антинаправленный трансмембранный перенос ионов натрия и калия), Са2+-АТФаза (выкачивание ионов кальция из клетки), глюкозные транспортеры.
Резервная функция
В качестве примера депонированного белка можно привести производство и накопление в яйце яичного альбумина. У животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканей и печени.
Сократительная функция
Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин).
Защитная функция
Защитную функцию, предупреждая инфекционный процесс и сохраняя устойчивость организма, выполняют иммуноглобулины крови, факторы системы комплемента (пропердин), при повреждении тканей работают белки свертывающей системы крови — например, фибриноген, протромбин, антигемофильный глобулин. Механическую защиту в виде слизистых и кожи осуществляют коллаген и протеогликаны.
К данной функции также можно отнести поддержание постоянства коллоидно-осмотического давления крови, интерстиция и внутриклеточных пространств, а также иные функции белков крови.
Белковая буферная система участвует в поддержании кислотно-щелочного состояния.
Существуют белки, которые являются предметом особого изучения:
Монеллин – выделен из африканского растения, обладает очень сладким вкусом, не токсичен и не способствует ожирению.
Резилин – обладает почти идеальной эластичностью, составляет „шарниры» в местах прикрепления крыльев насекомых.
Белки со свойствами антифриза обнаружены у антарктических рыб, они предохраняют кровь от замерзания
Патомеханизмы
Прекрасное понимание того, как мутации MYBPC3 приводят к развитию наследственной кардиомиопатии, пришло из анализа образцов миокарда человека, переноса генов в различных клеточных линиях, моделей естественных или трансгенных животных и недавнего моделирования заболеваний с использованием индуцированных плюрипотентных стволовых клеток ( ИПСК ). -производные сердечные миоциты. Хотя доступ к образцам миокарда человека затруднен, по крайней мере, некоторые исследования предоставили доказательства того, что усеченные cMyBP-Cs, возникающие в результате усечения мутаций MYBPC3 , не обнаруживаются в образцах пациентов-людей с помощью Вестерн-иммуноблот-анализа. Это предложение было поддержано в гетерозиготном Mybpc3 -targeted нокаут у мышей, неся человека c.772G> Переход (т.е. мутации основателя в Тоскане Эти данные свидетельствуют о том гаплонедостаточность в качестве основного механизма заболевания у гетерозиготных усечения мутаций. Совокупность доказательств существует , что механизмы регуляция экспрессии мутантного аллеля включает нонсенс-опосредованный распад мРНК , убиквитин-протеасомную систему (UPS) и аутофагию-лизосомный путь после переноса гена мутантного MYBPC3 в сердечные миоциты или у мышей in vivo . В отличие от усекающих мутаций, missense мутации приводят, в большинстве случаев (хотя их трудно специфически обнаружить), к стабильным мутантным cMyBP-C, которые, по крайней мере частично, включены в саркомер и могут действовать как ядовитые полипептиды в структуре и / или функции саркомера. Следовательно, гомозиготные или сложные гетерозиготные мутации, вероятно, подлежат дифференциальному регулированию в зависимости от того, являются ли они двойным миссенс, двойным усечением или двойным усечением. r смешанные миссенс / усекающие мутации. Гомозиготные мыши Mybpc3, нацеленные на нокаут, которые генетически имитируют ситуацию тяжелой неонатальной кардиомиопатии, рождаются без фенотипа, и вскоре после рождения у них развивается систолическая дисфункция с последующей (компенсаторной) гипертрофией сердца. Переход c.772G> A человека приводит к низким уровням трех различных мРНК Mybpc3 и cMyBP-C у гомозиготных мышей, что предполагает сочетание гаплонедостаточности и отравления полипептидами как механизма заболевания в гомозиготном состоянии. Кроме того, было показано , что сочетание внешнего стресса (например, нейрогуморального стресса или старения) и мутаций Mybpc3 нарушает UPS у мышей, а протеасомная активность также снижается у пациентов с гипертрофической кардиомиопатией или дилатационной кардиомиопатией .
Кожные трабекулы или сердечные миоциты, полученные от пациентов-людей, несущих мутацию MYBPC3, или от гетерозиготных и гомозиготных мышей, нацеленных на Mybpc3, демонстрировали более высокую чувствительность миофиламентов к Са2 +, чем контрольные. Моделирование заболеваний с помощью технологии инженерной ткани сердца ( EHT ) с сердечными клетками от гетерозиготных или гомозиготных Mybpc3- целевых мышей воспроизводило наблюдения, сделанные в исследованиях на людях и мышах, демонстрирующие сокращенные сокращения, большую чувствительность к внешнему Ca2 + и меньшую инотропную реакцию на различные лекарства ( изопреналин, EMD 57033 и верапамил) по сравнению с контрольными EHT дикого типа. Следовательно, EHT подходят для моделирования фенотипа заболевания и повторения функциональных изменений, обнаруженных у мышей с гипертрофической кардиомиопатией . Еще одна хорошая система для моделирования кардиомиопатий в чашке для культивирования клеток — это получение сердечных миоцитов из ИПСК . Отчеты о человеческих iPSC-моделях саркомерных кардиомиопатий показали клеточную гипертрофию в большинстве случаев, в том числе с мутацией c.2995_3010del MYBPC3, которая помимо гипертрофии проявляла вариабельность сократительной способности в присутствии эндотелина-1 .
Миозин
миозин и актин, миозин фотоМиозин — фибриллярный белок, один из главных компонентов сократительных волокон мышц — миофибрилл. Составляет 40—60 % общего количества мышечных белков. При соединении миозина с другим белком миофибрилл (актином) образуется актомиозин — основной структурный элемент сократительной системы мышц.
Другое важное свойство миозина — способность расщеплять аденозинтрифосфорную кислоту (АТФ). Благодаря АТФ-азной активности миозина, химическая энергия макроэргических связей АТФ превращается в механическую энергию мышечного сокращения
Молекулярная масса миозина около 500 000.
При действии протеолитических ферментов миозин распадается на фрагменты — тяжёлый меромиозин и лёгкий меромиозин (молекулярная масса около 350 000 и около 150 000). С помощью меченного тяжёлого меромиозиона при цитологических исследованиях выявляется местоположение актиновых микрофиламентов в клетке.
- 1 Структура
- 2 Виды миозина
- 2.1 Мышечный миозин
- 2.2 Немышечный миозин
- 3 Примечания
- 4 См. также
Структура
Миозины — семейство белков, являющихся моторами цитоскелета системы микрофиламентов. Миозины состоят из тяжёлых цепей (H) и лёгких (L) в разном количестве в зависимости от типа миозина. H-цепь имеет 2 участка — «головку» и «хвостик».
Головка тяжёлой цепи миозина имеет сайт связывания с актином и сайт связывания АТФ. По количеству «головок» миозины делятся на «традиционные» (convention myosin) — 2 головки, и нетрадиционные (unconvention myosin) — одна «головка».
Традиционные миозины могут связываться между собой в протофибриллы, а нетрадиционные — не могут.
На электронных микрофотографиях молекулы миозина имеют вид палочек (1600´25) с двумя глобулярными образованиями на одном из концов. Полагают, что 2 полипептидные цепи, образующие миозина, скручены в спираль. Белки, аналогичные миозину, обнаружены в жгутиках, ресничках и других двигательных структурах у многих простейших и бактерий, сперматозоидов животных и некоторых растений.
Мышечный миозин
Мышечный миозин (т. н. Миозин II) — традиционного типа. Обнаруживается в поперечно-полосатой мускулатуре позвоночных и беспозвоночных животных, в гладкомышечных клетках беспозвоночных. Мышечный миозин всегда состоит из двух H-цепей, по 200 кДа каждая, образующих две «головки» молекулы и скрученный из двух хвостиков тяжёлой цепи хвост.
Две лёгкие L-цепи по 18 кДа ассоциированы с тяжёлыми цепями в районе перехода от головки к хвосту. Связываясь с микрофиламентами головками попеременно, миозины как бы «шагают» по нему за счёт гидролиза макроэргической связи молекулы АТФ.
При этом к хвосту молекулы может быть присоединена соседняя микрофибрилла, и тогда происходит мышечное сокращение.
Немышечный миозин
Миозин V
Немышечные миозины встречаются в разных клетках, в том числе в гладко-мышечных клетках позвоночных. Немышечные миозины могут быть 2-х-головые и одно-головые, то есть традиционные и нетрадиционные.
Нетрадиционные миозины найдены во всех клетках. Они не могут образовывать протофиламенты. Одноголовый миозин тащит груз от (-) конца микрофиламента к (+)-концу.
Миозин I — в фоторецепторах, миозин VII — в органах слуха.
См. также
п·о·р Биологические двигатели
| Актин • Динеин • Кинезин • Миозин • Тропомиозин • Тропонин • Флагеллин |
| См. также: Молекулярные моторы |
миозин, миозин и актин, миозин и актин титин, миозин фото, миозински филаменти
Миозин Информацию О
Миозин
МиозинМиозин Вы просматриваете субъектМиозин что, Миозин кто, Миозин описание
There are excerpts from wikipedia on this article and video
Поисковая система, разработанная для вас, доставляет вам самую актуальную и точную информацию с простым дизайном и системой быстрого функционирования. Вы можете найти почти любую информацию, которую вы ищете на нашем сайте.
На данный момент мы служим только на английском, турецком, русском, украинском, казахском и белорусском языках. Очень скоро в систему будут добавлены новые языки.
Жизнь известных людей дает вам информацию, изображения и видео о сотнях тем, таких как политики, правительственные деятели, врачи, интернет-сайты, растения, технологические транспортные средства, автомобили и т. д.
Медицинские офисы KDLmed
- КЛИНИКА 1
- КЛИНИКА 2
- КЛИНИКА 3
АДРЕС:г. Пятигорск, проспект 40 лет Октября, 62/3
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 14:00 / вс 8:30 — 13:00
Взятие крови: пн-сб 7:30 — 12:00
вс 8:30 — 12:00
Взятие мазка: пн-пт 7:30 — 16:00
сб 7:30 — 13:30 / вс 8:30 — 12:00
ТЕЛЕФОН:(8793) 330-640
+7 (928) 225-26-74
АДРЕС:г. Пятигорск, проспект 40 лет Октября, 14
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 14:00 / вс 8:30 — 13:00
Взятие крови: пн-сб 7:30 — 12:00
вс 8:30 — 12:00
Взятие мазка: пн-пт 7:30 — 16:00
сб 7:30 — 13:30 / вс 8:30 — 12:00
ТЕЛЕФОН:(8793) 327-327
+7 (938) 302-23-86
АДРЕС:г. Пятигорск, ул. Адмиральского, 6А
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 14:00
Взятие крови: пн-сб 7:30 — 12:00
Взятие мазка: пн-пт 7:30 — 16:00
сб 7:30 — 13:30
ТЕЛЕФОН:(8793) 98-13-00
+7 (928) 363-81-28
АДРЕС:г. Ставрополь, ул. Ленина, 301
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 15:00
сб 7:30 — 14:00 / вс 8:30 — 13:00
ТЕЛЕФОН:(8652) 35-00-01
+7 (938) 316-82-52
- КЛИНИКА 1
- КЛИНИКА 2
АДРЕС:г. Невинномысск, ул. Гагарина, 19
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 16:00
сб 7:30 — 15:00
вс 8:30 — 14:00
ТЕЛЕФОН:(86554) 7-08-18
+7 (928) 303-82-18
АДРЕС:г.Невинномысск, ул. Гагарина, 60
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 16:00
сб 7:30 — 13:00
ТЕЛЕФОН:8 (86554) 6-08-81
8 (938) 347-42-17
АДРЕС:г. Нефтекумск, 1-й микрорайон, ул. Дзержинского, 7
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 13:00
ТЕЛЕФОН:(86558) 4-43-83
+7 (928) 825-13-43
АДРЕС:г. Буденновск, пр. Энтузиастов, 11-Б
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 13:00
вс 8:30 — 13:00
ТЕЛЕФОН:(86559) 5-55-95
+7 (938) 302-23-89
АДРЕС:г. Зеленокумск, ул. Гоголя, д.83
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 13:00
вс 8:30 — 13:00
ТЕЛЕФОН:(86552) 6-62-14
+7 (938) 302-23-90
АДРЕС:г. Минеральные Воды, ул. Горская, 61, 13/14
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 16:00
сб 7:30 — 16:00 / вс 8:30 — 15:00
ТЕЛЕФОН:(87922) 6-59-29
+7 (938) 302-23-88
- КЛИНИКА 1
- КЛИНИКА 2
АДРЕС:г. Ессентуки, ул. Володарского, 32
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 16:00
сб 7:30 — 14:30 / вс 8:30 — 13:00
ТЕЛЕФОН:(87934) 6-62-22
+7 (938) 316-82-51
АДРЕС:г.Ессентуки, ул.Октябрьская 459 а
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 15:00
сб 7:30 — 14:30
ТЕЛЕФОН:(87934) 99-2-10
+7 (938) 300-75-28
АДРЕС:г. Георгиевск, ул. Ленина, 123/1
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 16:00
сб 7:30 — 14:00 / вс 8:30 — 13:00
ТЕЛЕФОН:(87951) 50-9-50
+7 (938) 302-23-87
АДРЕС:г. Благодарный, ул. Первомайская, 38
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 15:00
сб 7:30 — 13:00
ТЕЛЕФОН:(86549) 24-0-24
+7 (928) 363-81-37
АДРЕС:г. Светлоград, ул. Пушкина, 19 (Центр, Собор)
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 15:00
сб 7:30 — 13:00
ТЕЛЕФОН:(86547) 40-1-40
+7 (928) 363-81-41
АДРЕС:с. Донское, ул. 19 Съезда ВЛКСМ, 4 А
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 16:00
сб 7:30 — 13:00
ТЕЛЕФОН:(86546) 34-330
+7 (928) 363-81-25
АДРЕС:г. Новоалександровск, ул. Гагарина, 271 (пересечение с ул. Пушкина)
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 13:00
ТЕЛЕФОН:8(86544) 5-46-44
+7 (928) 363-81-45
АДРЕС:с. Александровское, ул. Гагарина, 24
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 15:00
сб 7:30 — 13:00
ТЕЛЕФОН:(86557) 2-13-00
+7 (928) 363-81-35
АДРЕС:с. Кочубеевское, ул. Братская, 98 (ТЦ «ЦУМ»)
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 13:00
сб 7:30 — 13:00
вс 8:30 — 13:00
ТЕЛЕФОН:(86550) 500-22
+7 (928) 363-81-42
АДРЕС:г. Железноводск, ул. Ленина, 127
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 17.30
сб 7:30 — 13:00
ТЕЛЕФОН:(87932) 32-8-26
+7 (928) 363-81-30
АДРЕС:с. Арзгир, ул. Кирова, 21 (Рынок)
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 14:00
сб 7:30 — 13:00
ТЕЛЕФОН:(86560) 31-0-41
+7 (928) 363-81-44
АДРЕС:г.Ипатово, ул. Ленинградская, 54
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 13:00
ТЕЛЕФОН:8 (86542) 5-85-15
8 (938) 347-42-16
АДРЕС:ст. Ессентукская, ул. Павлова, 17
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 16:00
сб 7:30 — 14:30
ТЕЛЕФОН:8 (87961) 6-61-00
8 (938) 347-42-18
АДРЕС:ст. Курская, ул. Калинина, д. 188
ВРЕМЯ РАБОТЫ:пн-пт 7:30 — 18:00
сб 7:30 — 13:00
ТЕЛЕФОН:8(87964) 5-40-10
8(938) 347-43-29
- Пятигорск
- Ставрополь
- Невинномысск
- Нефтекумск
- Буденновск
- Зеленокумск
- Минеральные Воды
- Ессентуки
- Георгиевск
- Благодарный
- Светлоград
- Донское
- Новоалександровск
- Александровское
- Кочубеевское
- Железноводск
- Арзгир
- Ипатово
- Ессентукская
- Курская
Основные свойства белков
Структура и свойства белков могут изменяться под влиянием разных физико-химических факторов: действие концентрированных кислот и щелочей, тяжелых металлов, изменение температуры и т. п. Одни из белков легко изменяют структуру под незначительным действием разнообразных факторов, другие – стойкие к подобным влияниям. Основные свойства белка это – денатурация, ренатурация, деструкция.
Денатурация
Денатурация – это процесс нарушения естественной структуры белка с сохранением пептидных связей (первичной структуры). Может быть необратимым процессом. Но при условии прекращения действия отрицательных факторов на первых стадиях белок может восстанавливать свое нормальное состояние, то есть происходит обратная денатурация – ренатурация.
Ренатурация
Ренатурация – это способность белка восстанавливать нормальную структуру после устранения действия отрицательных факторов. Выполнение некоторых функций – двигательной, сигнальной, каталитической и т. п. – у живых организмов связано с частичной обратной денатурацией белков.
Основные функции
Принято выделять 11 функций белка:
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут
- Транспортная.
- Строительная
- Регуляторная.
- Защитная.
- Двигательная.
- Сигнальная.
- Запасающая.
- Энергетическая.
- Каталитическая или ферментативная.
- Функция антифриза.
- Резервная или питательная.
Транспортная
Уникальная способность белков заключается в их умении присоединять различные вещества и транспортировать их к тем или иным тканям и органам:
- гемоглобин — белок в крови. Присоединяет к себе кислород и переносит его от легких ко всем органам и тканям, а от них забирает углекислый газ и перевозит обратно в легкие;
- липопротеины (от греческого lípos (Λίπος) — «жир», proteḯni (πρωτεΐνη) — «белок»). Отвечают за транспортировку жира;
- гаптоглобин. Связывает гемоглобин, попадающий в кровь при повреждении эритроцитов, и свободный гемоглобин, образуя комплекс гемоглобин-гаптоглобин. Он поглощается и утилизируется клетками печени. Печень возвращает организму аминокислоты глобина и железо гема;
- трансферрин. Вырабатывается в печени, связывает железо и переносит его по телу.
Белки выступают трансфером ионов кальция, магния, железа, меди и др.
Строительная
Белки участвуют в образовании клеточных и внеклеточных составов:
кератин. Основной компонент в составе волос, ногтей, перьев или копыт;
- коллаген. Главный элемент сухожилий и хрящей;
- эластин. Входит в состав связок;
- белки клеточных мембран. В основном это гликопротеины.
Регуляторная
Существует отдельная, довольно крупная группа белков, которая ориентируется на регулирование процессов обмена веществ. В этом принимают участие особые гормоны белковой природы. К примеру, инсулин, который контролирует уровень глюкозы в крови и способствует синтезу гликогена.
Защитная
Включается в случае проникновения в организм чужеродных белков или других микроорганизмов, антигенов. В ответ на нападение образуются специальные белки, антитела, которые выполняют функцию обезвреживания нежелательных веществ.
При кровотечении помогает фибрин, способствующий свертыванию крови.
Двигательная
Белки актин и миозин необходимы для сокращения мышц у многоклеточных организмов и других подвижных функций живых существ.
Сигнальная
На клетках есть мембраны, в которые встроены особые рецепторы. Это белки, которые могут изменять свою третичную структуру в зависимости от внешней среды. Так осуществляется передача команд из внешней среды в клетку.
Запасающая
В случаях длительного голодания организм животных или человека использует белки мышц, эпителиальных тканей и печени для поддержания жизнедеятельности организма.
Кроме того, белки участвуют в откладывании в качестве запаса некоторых веществ. Таким веществом может бы железо, которое не выводится из организма при распаде гемоглобина, а образует комплекс с белком ферритином.
Энергетическая
В качестве источника энергии белки — очень дорогостоящий продукт для нашего тела. Он используется в последнюю очередь, когда израсходованы все углеводы и жиры. При распаде 1 грамма белка выделяется 17,6 кДж энергии. Первым делом они распадаются до аминокислот, а потом до конечных продуктов: воды, углекислого газа и аммиака.
Каталитическая (ферментативная)
Одна из самых важных для организма функций осуществляется за счет особых белков, ферментов (биохимических катализаторов). Они ускоряют биохимические реакции в клетках.
Ферменты можно разделить на:
- Простые. Состоят исключительно из аминокислот.
- Сложные. Помимо белковой части в их состав входит группа небелкового происхождения (кофактор). У некоторых ферментов эту роль играют витамины.
Функция антифриза
У некоторых существ в плазме крови есть белки, которые предупреждают ее замерзание. Такая способность белка является необходимой для выживания в условиях экстремально низких температур.
Питательная (резервная)
Ее выполняют резервные белки, которые становятся для плода источниками питания. В качестве примера можно привести белки яйца (овальбумины) или основной белок молока (казеин).
Результаты
Концентрация гликогена, содержание жидкости и концентрации саркоплазматических белков за время тренировок существенно не изменились. Однако концентрации актина и миозина и активность цитратсинтазы к концу исследования значительно снизились (p = 0.035). Более того, хотя изменения концентрации саркоплазматических белков были несущественными, они имели тенденцию к росту (среднее изменение составило около 23%, p = 0.065), но сильно варьировали.
Обратите внимание: содержание сократительных белков не снижается. Сколько их было, столько и осталось
В химически окрашенных волокнах количество актина в одном волокне существенно не меняется. Однако волокно растет, что приводит к снижению концентрации актина. Также стоит отметить, что перед тренировкой и после трех недель занятий общее содержание актина было тесно связано с площадью поперечного сечения волокна (r2 = 0,815 перед тренировкой и 0,867 после трех недель тренировки). Однако через шесть недель достоверной связи между содержанием актина и площадью поперечного сечения волокна не было (r2 = 0.160; p = 0.22).
Несмотря на снижение концентраций актина и миозина, средние значения маркеров расщепления белка (активность протеасом 20S и содержание убиквитинированного белка) и повреждения мышц (активность креатинкиназы сыворотки) существенно не изменились.
Хотя общая концентрация белков саркоплазмы не увеличилась, концентрация отдельных белков возросла, в том числе связанных с гликолизом и глюконеогенезом.
У той семерки, которым делали дополнительную биопсию, площадь поперечного сечения через 8 дней после окончания тренировок вернулась к начальному уровню. В отличие от полной выборки из 15 человек, содержание саркопламатических белков у этой семерки значительно возросло к концу тренировочной программы и стало еще больше после недели отдыха. Соответственно, концентрации актина и миозина имели тенденцию к снижению.
Практическое применение и выводы
- Саркоплазматическая гипертрофия не миф, она реально существует.
- Выраженность саркоплазматической гипертрофии может зависеть от числа повторений (она особенно заметна при 8-10 и более повторах) и от количества подходов (чем их больше, тем сильнее выражена гипертрофия). Она может также зависеть от стажа тренировки, поскольку сильнее проявляется у более опытных атлетов. Этот вывод исходит из предположения, что саркоплазматическая гипертрофия стимулирует усиление анаэробного метаболизма.
- Нам нужно гораздо больше исследований, чтобы разобраться во всех деталях.
Этой фразой теперь заканчивается обсуждение практически любой научной статьи: «Необходимы дальнейшие исследования».