Мутация
Содержание:
- Виды мутаций
- Причины появления
- Полиморфизм гена MTHFR
- С какими онкологическими заболеваниями связаны мутации в гене ALK?
- Возрастающая роль сигнального пути RAS в индивидуализированной терапии мКРР
- Как протекает процесс мутагенеза
- Причины мутаций
- Литература
- Модели мутагенеза
- Кому это нужно?
- Как происходят мутации, и чем это грозит?
- Насколько сильно повышается риск рака?
- Примеры мутационной изменчивости в биологии
Виды мутаций
Мутации происходят не по какой-то одной причине. Это целый процесс, который становится возможным на клеточном уровне организма. К настоящему времени ученые выделяют 4 основных вида мутаций:
- Генные;
- Хромосомные;
- Геномные;
- Цитоплазматические.
Ученые пришли к выводу, что большинство из мутаций вредны, и природа устроена так, что из-за естественного отбора они исчезают у людей самостоятельно. Однако выделяют и такие мутации, которые повышают жизнеспособность организма. Тем более некоторые изменения генов могут быть вредны в одних условиях окружающей среды, но при этом полезны в других.
Различают два подвида мутаций:
- Спонтанные
- Индуцированные
Спонтанные мутации возникают случайно — например, если в стаде овец внезапно родилась овца с более короткими ногами. Или появление черной зебры среди обычных, кошек с белыми лапами и так далее. Спонтанные мутации бывают и у человека, причем вы можете даже не знать о том, что в вашем организме происходят какие-то изменения. Они чаще всего носят «косметический» характер и представляют собой изменение комбинации генов.
Появление черной зебры сначала посчитали аномалией и даже связали с религией
Индуцированные мутации являются «искусственными» и возникают под воздействием химических веществ, различных излучений, биологических объектов, например, вирусов. Да, именно такие мутации есть у большинства супергероев из комиксов — от «Человека-паука» до «Росомахи» (ну или «Дедпула», раз уж на то пошло).
Индуцированные мутации в кино дают супергероям сверхспособности
Генные мутации
При таком виде мутаций, как правило, затрагивается только один конкретный ген. Генные мутации возникают как при замещении одного гена другим, так и при выпадении какого-то гена из общей цепочки или при перевороте участка молекулы ДНК, который затрагивает один ген.
При генной мутации происходит изменение только одного гена
Подобные мутации могут быть как спонтанными, так и индуцированными: например, та же черная зебра стала такой, потому что ген, отвечающий за изменение ее цвета, был заменен другим по естественной причине. Также генные мутации возникают при облучении, контакте с химическими веществами или вирусами.
Хромосомные мутации
При хромосомных мутациях затрагивается не один ген, а несколько. Такие мутации гораздо более опасные, чем просто генные: если изменению подвержено слишком много генов, клетка уже не может делиться и начинает самоуничтожаться. Известны случаи, когда некоторые люди и животные погибали из-за таких мутаций, поскольку хромосомы в их клетках утрачивались или удваивались, что приводило к нарушению обменных процессов в организме.
Хромосомные мутации затрагивают сразу несколько генов
При хромосомных мутациях возможно как выпадение участка хромосомы, так и удвоение хромосомы, поворот участка хромосомы на 180 градусов или даже ее перемещение в другое место. Это приводит к болезням Прадера-Вилли (ожирение, низкий рост и интеллект одновременно) и Вольфа-Хиршхорна (задержка умственного развития).
Делеция – выпадение участка хромосомы
Дупликация – удвоение какого-то участка хромосом
Инверсия – поворот участка хромосомы на 180 градусов
Транслокация – перемещение какого либо участка хромосомы
Геномные мутации
Этот вид мутаций еще страшнее, поскольку затрагивает не один или несколько генов, а целый геном. Геномный вид мутаций возникает в следствие ошибок при расхождении хромосом. Причем он довольно интересный: если изменение хромосом кратное, то в организме увеличиваются клетки и внутренние органы — такие мутации ученые ранее наблюдали у некоторых растений и животных.
Кукуруза растет благодаря геномной мутации
Однако если количество хромосом меняется не кратно, в организме происходят отрицательные процессы. К примеру, для человека характерна мутация трисомия 21: в этом случае не расходится двадцать первая пара хромосом, в результате ребенок получает не две двадцать первые хромосомы, а три. Это приводит к развитию синдрома Дауна, в результате чего ребенок получается умственно и физически неполноценным.
Цитоплазматические мутации
Они возникают вследствие нарушения ДНК митохондрий, из которых состоят клетки. Это одни из самых редкий мутаций, которые еще слабо изучены. Однако ученые уже пришли к выводу, что цитоплазматические мутации приводят к нарушению зрения и проблемам с центральной нервной системой. Есть теория, что данный вид мутаций также отвечает за появление сахарного диабета.
Причины появления
Геномы животных и человека относительно стабильны, что сохраняет видовую структуру и возможность нормального развития. Для поддержания этого процесса в клетках работают репарационные системы, они исправляют нарушения в цепи ДНК. Но если бы изменения вообще не могли сохраняться, то живые организмы не приспособились бы к новым условиям обитания. Процесс эволюции остановился бы. Большое значение для создания должного уровня наследственной изменчивости имеют мутации.
Термин впервые встречается в работе де Фриза «Мутационная теория». В этом труде ученый выявил прерывистые скачкообразные изменения в цепи ДНК. Он выделил основные особенности мутации:
- формы константы;
- возможность вторичного возникновения;
- разделение на полезные и вредные;
- зависимость от количества исследованных видов.
Существует два типа мутаций — индуцированные и спонтанные. В первом случае изменения возникают из-за наследственности, а у предков они появлялись из-за неблагоприятных условий окружающей среды или в результате экспериментов. Спонтанные зарождаются самопроизвольно в течение всей жизни даже при нормальных условиях обитания. Они встречаются с довольно маленькой частотой на нуклеотид за клеточную генерацию.
Полиморфизм гена MTHFR
Описано две разновидности гена MTHFR. Наиболее изученной является вариант, в котором нуклеотид цитозин (C) в позиции 677, относящейся к 4-му экзону, заменен на тимидин (T), что приводит к замене аминокислотного остатка аланина на остаток валина в сайте связывания фолата. Такой полиморфизм MTHR обозначается как мутация C677T. У лиц, гомозиготных по данной мутации, отмечается термолабильность MTHFR и снижение активности фермента примерно до 35% от среднего значения. Кроме того, у лиц, гомозиготных по данной мутации, отмечается нарушенное распределение фолатов в эритроцитах, выражающееся в накоплении формильных полиглютаматов тетраглютамата и метилированных дериватов тетрагидрофолата. Наличие этой мутации сопровождается повышением уровня гомоцистеина в крови.
Другим вариантом полиморфизма гена MTHFR является замена нуклеотида аденина (A) на цитозин (C) в позиции 1298. Это приводит к замене остатка глутамина на остаток аланина в регуляторном домене фермента, что сопровождается небольшим снижением активности. У лиц, гомозиготных по мутации А1298C, отмечается снижение активности MTHFR примерно до 60% от нормы. Предполагается, что снижение активности фермента связано с изменением регуляции фермента его ингибитором S-аденозилметионином.
В отличие от полиморфизма C677T, гетерозиготность и гомозиготность по мутации А1298C не сопровождается ни повышением концентрации общего гомоцистеина, ни снижением уровня фолата в плазме. Однако комбинация гетерозиготности аллелей 677T и 1298C сопровождается не только снижением активности фермента, но и повышением концентрации гомоцистеина в плазме и снижением уровня фолата, как это бывает при гомозиготности 677T.
Диагностика гомо- и гетерозиготности по аллелям 677T и 1298C производится методом полимеразной цепной реакции (ПЦР).
С какими онкологическими заболеваниями связаны мутации в гене ALK?
В настоящее время известно, что изменения в этом гене встречаются не только при анапластической крупноклеточной лимфоме, но и при ряде других злокачественных опухолей: нейробластоме, немелкоклеточном раке легкого, почечно-клеточном раке, плоскоклеточном раке пищевода.
Мутации ALK при немелкоклеточном раке легкого
Генетические перестройки с участием ALK встречаются в 3–7% случаев при немелкоклеточном раке легкого. Причем, чаще всего эти мутации обнаруживаются у определенных категорий пациентов:
- люди, которые не являются курильщиками или курят редко, немного;
- больные молодого возраста;
- пациенты со злокачественными опухолями легких, которые по результатам гистологического исследования относят к аденокарциномам;
- женщины;
- известно, что мутации ALK практически никогда не встречаются вместе с мутациями EGFR и KRAS.
Например, в 13% случаев при аденокарциномах легкого присутствует транслокация (перемещение участка одной хромосомы на другую) и/или химерный ген EML4-ALK. Ген EML4 кодирует белок, подобный ассоциированному с микротрубочками иглокожих белку. Такая связь приводит к чрезмерной активации ALK.
В каких случаях назначают анализ на мутации ALK при раке легкого, и для чего это нужно?
В соответствии с рекомендациями Международной ассоциации по изучению рака легких (IASLC) и Европейского общества медицинской онкологии (ESMO), у всех пациентов с аденокарциномой легких на поздних стадиях необходимо проводить анализы на мутации ALK. Обычно их назначают вместе с анализом на мутации EGFR или после него, если он показал отрицательный результат.
Исследование на мутации ALK помогает разобраться, будет ли эффективно лечение таргетными препаратами — ингибиторами рецепторной тирозинкиназы ALK: кризотинибом (Ксалкори), церитинибом (Зикадия), алектинибом (Алеценза). Эти препараты помогают более успешно бороться с запущенным ALK-положительным немелкоклеточным раком легкого, повысить выживаемость.
Мутации в гене ALK при нейробластоме
Нейробластомами называют злокачественные опухоли из незрелых нервных клеток, нейробластов. Они могут развиваться в разных частях тела: головном мозге, нервной ткани шеи, грудной клетки, брюшной полости, таза, надпочечников. Чаще всего нейробластомы диагностируют у детей младше 5 лет. На данный момент известно по крайней мере 16 видов генетических дефектов с вовлечением гена ALK, которые встречаются у таких пациентов. Эти мутации могут быть как соматическими, при спорадических случаях заболевания, так и наследственными, связанными с наследственной формой нейробластомы.
Одна из наиболее распространенных мутаций ALK при нейробластоме — замена аминокислоты аргинина на глутамин в положении 1275. Она обозначается как Arg1275Gln или R1275Q и бывает как наследственной, так и соматической.
В некоторых случаях встречается увеличение копий гена ALK — амплификация. За счет этого он становится чрезмерно активным. Сигнальный путь постоянно находится во «включенном» состоянии, и ему больше не требуется стимуляции извне.
Мутации в гене ALK при анапластической крупноклеточной лимфоме
Анапластическая крупноклеточная лимфома (АККЛ) — редкая агрессивная разновидность неходжкинских периферических T-клеточных лимфом, злокачественных опухолей из лимфоидной ткани. Слово «T-клеточная» в названии говорит о том, что нарушение произошло в T-лимфоцитах, а «периферическая» — то, что эти клетки циркулируют в периферической крови. АККЛ составляет 3% от всех лимфом у взрослых и 10–20% у детей. Мутации в гене ALK при этом заболевании играют настолько важную роль, что они даже легли в основу его классификации на два подтипа: выделяют ALK-положительные и ALK-отрицательные АККЛ.
Наибольшее значение при анапластических крупноклеточных лимфомах имеют хромосомные изменения с образованием химерных генов. В 70–80% случаев при ALK-положительных АККЛ определяется химерный ген, образованный генами ALK и NPM. Последний кодирует нуклеофозмин — белок, который участвует в регуляции деления клеток, репарации («починки») ДНК, транскрипции (синтеза РНК на матрице ДНК) и стабильности генома. За счет соединения двух генов активность ALK сильно повышается.
В остальных 20–30% случаев формирование химерного антигена происходит с другими генами, такими как ALO17, TFG, MSN, TPM3, TPM4, ATIC, MYH9, CLTC.
Возрастающая роль сигнального пути RAS в индивидуализированной терапии мКРР
Самым известным биомаркером в таргетной анти-EGFR терапии пациентов c мКРР является статус мутаций кодонов 12 и 13 гена KRAS. Доказано, что активация KRAS за счет мутации сводит на нет эффект ингибирования EGFR моноклональными антителами. Таким образом, наличие мутантных аллелей гена KRAS является независимым предсказательным маркером эффективности терапии ингибиторами EGFR. Поэтому панитумумаб и цетуксимаб назначают только больным мКРР с диким типом гена KRAS.
Влияние дополнительных мутаций гена KRAS и новых мутаций гена NRAS, а также мутаций гена BRAF на эффективность таргетной терапии ингибиторами EGFR изучалось в исследованиях с панитумумабом и цетуксимабом пациентов мКРР:
- Анализ мутаций генов KRAS/NRAS и мутации гена BRAF в исследовании 3 фазы PRIME: комбинации панитумумаб+FOLFOX4 в сравнении с FOLFOX4 в 1-й линии терапии метастатического колоректального ракаOliner K, Douillard JY, Siena S, et al. Analysis of KRAS/NRAS and BRAF mutations in the phase III PRIME study of panitumumab (pmab) plus FOLFOX versus FOLFOX as first-line treatment (tx) for metastatic colorectal cancer (mCRC). ASCO 2013 (poster discussion): 3511
- Анализ мутаций генов RAS/RAF в исследовании 2 фазы PEAK: комбинации панитумумаба с mFOLFOX6 в сравнении с бевацизумабом в комбинации с mFOLFOX6 в 1-й линии терапии пациентов с метастатическим колоректальным раком с WTKRASSchwartzberg LS, Rivera F, Karthaus M, et al. PEAK (study 20070509): A randomized phase II study of mFOLFOX6 with either panitumumab (pmab) or bevacizumab (bev) as first-line (tx) in patients (pts) with unresectable wild type (WT) KRAS metastatic colorectal cancer (mCRC). J Clin Oncol 2013; 30 (Suppl 34): 446
- Анализ влияния мутаций генов семейства RAS (2 экзона KRAS и других RAS-мутаций) в исследовании CRYSTAL: комбинации цетукпсимаба с FOLFIRI в сравнении с FOLFIRI в 1-й линии терапии пациентов с метастатическим колоректальным раком на выживаемость пациентов без прогрессии и общую выживаемостьVan Cutsem et al. Fluorouracil, leucovorin, and irinotecan plus cetuximab treatment and RAS mutations in colorectal cancer. J Clin Oncol. 2015 Mar 1; 33(7): 692-700
Все исследования показали, что, несмотря на то, что индивидуализация терапии антителами по статусу генов семейства RAS предусматривает сужение круга пациентов (примерно 50/50 вместо 60/40 при отборе только лишь по статусу 2 экзона гена KRAS), пациенты с диким типом генов KRAS и NRAS в опухоли получат максимальную пользу от терапии антителами в комбинации со стандартной химиотерапией, по сравнению с пациентами без мутаций гена KRAS во 2 экзоне. Пока нет достаточных доказательств негативного влияния мутаций генов BRAF, PI3K, PTEN и других участников сигнального пути RAS-RAF-MEK-ERK-МАРК по результатам крупных проспективных рандомизированных исследований, однако не исключено, что появление таких исследований вновь существенно изменит наши представления о группе пациентов, для которых применение анти-EGFR антител окажется наиболее выгодным.
В связи с этим целью программы является максимально широкое внедрение генетического тестирования при колоректальном раке в ежедневную практику онкологов, как одного из важнейших условий проведения современной эффективной терапии у целевой группы пациентов.
Список литературы:
- Heldin CH. Dimerization of cell surface receptors in signal transduction. Cell 1995; vol.80, no.2, pp.213-223.
- Carpenterand G, Cohen S. Epidermal growth factor. J Biol Chem, 1990; vol.265, no.14, pp.7709-7712.
- Citri A, Yarden Y. EGF-ERBB signalling: towards the systems level. Nature Rev Molecular Cell Biol 2006; vol.7, no.7, pp.505-516.
- Boguski MS, McCormick F. Proteins regulating Ras and its relatives. Nature 1993; 366: 643-654.
- Vakiani E, Solit DB. KRAS and BRAF: drug targets and predictive biomarkers. J Pathol 2011; 223: 219-229.
- Edkins S, O’Meara S, Parker A, et al. Recurrent KRAS codon 146 mutations in human colorectal cancer. Cancer Biol Ther 2006; 5: 928-932.
- Janakiraman M, Vakiani E, Zeng Z, et al. Genomic and biological characterization of exon 4 KRAS mutations in human cancer. Cancer Res 2010; 70: 5901-5911.
- Soh J, Okumura N, Lockwood WW, et al. Oncogene mutations, copy number gains and mutant allele specific imbalance (MASI) frequently occur together in tumor cells. PLoS One. 2009, 14, no.4(10). P.7464.
Войтив базу данных
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Регистрацияв программе
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
Как протекает процесс мутагенеза
Механизм образования мутаций происходит так:
- повреждается ДНК. В случае, когда повреждение не восстановлено, происходит мутация;
- если при повреждении фрагмента ДНК и при вырождении генетического кода не происходит нарушения, то возникают мутации, которые впоследствии окажутся незначительными или вовсе не проявятся.
Мутант — это организм, во всех клетках которого произошли мутации. Он начинает развиваться из мутационной клетки — гаметы или зиготы. Часто мутация образуется не во всех соматических клетках — такой организм получил название генетическая мозаика.
В случае, если изменения произошли в генеративных клетках (гаметы, споры, клетки зародышевого пути), такой организм не будет считаться мутантом, но передаст часть мутаций наследникам.
Мутации возникают не сразу, т.к. их образованию предшествует предмутационное состояние. Репарационные системы стараются убрать такое состояние.
Определение
Репарационные системы — это ферменты и ферментативные реакции, способствующие восстановлению правильной структуры ДНК.
Репарационные системы основаны на разных ферментах, заключенных в генотипе клетки. Они препятствуют возникновению мутаций.
Причины мутаций
Мутации делятся на спонтанные и индуцированные.
Спонтанные мутации возникают самопроизвольно на протяжении всей жизни организма в нормальных для него условиях окружающей среды с частотой около 10−9{\displaystyle 10^{-9}} — 10−12{\displaystyle 10^{-12}} на нуклеотид за клеточную генерацию организма.
Индуцированными мутациями называют наследуемые изменения генома, возникающие в результате тех или иных мутагенных воздействий в искусственных (экспериментальных) условиях или при неблагоприятных воздействиях окружающей среды.
Мутации появляются постоянно в ходе процессов, происходящих в живой клетке. Основные процессы, приводящие к возникновению мутаций — репликация ДНК, нарушения репарации ДНК, транскрипции и генетическая рекомбинация.
Связь мутаций с репликацией ДНК
Многие спонтанные химические изменения нуклеотидов приводят к мутациям, которые возникают при репликации. Например, из-за дезаминирования цитозина напротив гуанина в цепь ДНК может включаться урацил (образуется пара У-Г вместо канонической пары Ц-Г). При репликации ДНК, напротив урацила в новую цепь включается аденин, образуется пара У-А, а при следующей репликации она заменяется на пару Т-А, то есть происходит транзиция (точечная замена пиримидина на другой пиримидин или пурина на другой пурин).
Связь мутаций с рекомбинацией ДНК
Из процессов, связанных с рекомбинацией, наиболее часто приводит к мутациям неравный кроссинговер. Он происходит обычно в тех случаях, когда в хромосоме имеется несколько дуплицированных копий исходного гена, сохранивших похожую последовательность нуклеотидов. В результате неравного кроссинговера в одной из рекомбинантных хромосом происходит дупликация, а в другой — делеция.
Связь мутаций с репарацией ДНК
Спонтанные повреждения ДНК встречаются довольно часто, такие события имеют место в каждой клетке. Для устранения последствий подобных повреждений имеются специальные репарационные механизмы (например, ошибочный участок ДНК вырезается и на этом месте восстанавливается исходный). Мутации возникают лишь тогда, когда репарационный механизм по каким-то причинам не работает или не справляется с устранением повреждений. Мутации, возникающие в генах, кодирующих белки, ответственные за репарацию, могут приводить к многократному повышению (мутаторный эффект) или понижению (антимутаторный эффект) частоты мутирования других генов.
Так, мутации генов многих ферментов системы приводят к резкому повышению частоты соматических мутаций у человека, а это, в свою очередь, приводит к развитию пигментной ксеродермы и злокачественных опухолей покровов. Мутации могут появляться не только при репликации, но и при репарации — эксцизионной репарации или при пострепликативной.
Литература
- http://www.activestudy.info/generativnye-i-somaticheskie-mutacii-2/
- http://studopedia.info/5-45142.html
- http://humbio.ru/humbio/genexp/001b2690.htm
- Керкадзе И.Г. Некоторые вопросы генетики чайного растения. Сообщение VIII. Соматическая мутация и клоновая селекция чая. // Субтропические культуры, 1983. № 1. С. 42-45.
- Борисова Е.М. Роль сортов и новых технологий в интенсивном садоводстве. // Сельскохозяйственная биология, 2003, № 5: С. 124-126.
- Гвасалия М.В. Частота и спектр хромосомных аберраций у сортов и форм чая при спонтанном мутагенезе. // Сельскохозяйственная биология. 2014. № 3. С. 65-69
- Новицкая Л.Л. Карельская береза: механизмы роста и развития структурных аномалий. Петрозаводск: Verso, 2008. 144 c.
- Барсукова Т.Л. Изменчивоть березы карельской по морфологическим формам в культурах разного возраста в условиях Беларуси // Структурные и функциональные отклонения от нормального роста и развития растений под воздействием факторов среды: Материалы Международной конференции. Петрозаводск, Карельский научный центр РАН. 2011. С. 29-33.
- Коровин В.В. Структурные аномалии стебля древеных растений: итоги наблюдений // Структурные и функциональные отклонения от нормального роста и развития растений под воздействием факторов среды: Материалы Международной конференции. Петрозаводск, Карельский научный центр РАН. 2011. С. 131-136.
- https://ru.wikipedia.org/wiki/
- Ямбуров М.С. Морфологические особенности мутационной и паразитарной «ведьминых мётел» пихты сибирской //Вестник Томского государственного университета. Биология. – 2009. № 329. – С. 246-250.
- Ямбуров М. С., Горошкевич С. Н. «Ведьмины мётлы» кедра сибирского как спонтанные соматические мутации: встречаемость, свойства и возможности использования в селекционных программах // Хвойные бореальной зоны. — 2007. — Т. XXIV, № 2—3.
- Ямбуров М. С., Горошкевич С. Н., Третьякова И. Н., Хихлова О. В., Лукина А. В. Ведьмины мётла мутационного типа как перспективный источник для получения новых декоративных форм хвойных растений // Вестник Иркутской сельскохозяйственной академии. — 2011. — Т. 44, № 4. — С. 153-160.
- Муратова Е. Н., Седельникова Т. С. Геномные и хромосомные мутации у сосны обыкновенной (Pinus sylvestris L.) в экстремальных условиях произрастания // Хвойные бореальной зоны. — 2004. — С. 128—140.
- http://kedr.forest.ru
- Усольцев В/А. «Ведьмину метлу» – на улицы наших городов // Экопотенциал. – 2013. № 3–4. – С. 111-115.
- Коровин В.В., Курносов Г.А. Структурные аномалии: случайность или … // Лесной вестник. 2009. — № 1. С. 26-31.
- James Lignotubers and burls/ Their structure, function and ecological significance in Mediterranean ecosystem. // Bot. Rev., 1984. V. 50, N 3. P. 225–266
- Коровин В.В. Аномальные, предположительно мутантные, изменения морфологии сосны обыкновенной в ленточных борах Алтая // Тез.докл. Междун.научно-практической конф. Воронеж. 1996. С. 13-14.
- Радиоактивное загрязнение растительности Беларуси (в связи с аварией на Чернобыльской АЭС) / отв. ред. В.И Парфенов, Б.И. Якушев // Мн.: Навука i тэхнiка, 1995 – 581 с.
Шамаль Наталья Владимировна
Наталья Шамаль, старший научный сотрудник лаборатории моделирования и минимизации антропогенных рисков
Модели мутагенеза
В настоящее время существует несколько подходов для объяснения природы и механизмов образования мутаций. Общепринятой, в настоящее время, является полимеразная модель мутагенеза. Она основана на идее о том, что единственной причиной образования мутаций являются случайные ошибки ДНК-полимера. В предложенной Уотсоном и Криком таутомерной модели мутагенеза впервые была высказана идея о том, что в основе мутагенеза лежит способность оснований ДНК находиться в различных таутомерных формах. Процесс образования мутаций рассматривается как чисто физико-химическое явление. Полимеразно-таутомерная модель ультрафиолетового мутагенеза опирается на идею о том, что при образовании цис-син циклобутановых пиримидиновых димеров может изменяться таутомерное состояние входящих в них оснований. Изучается склонный к ошибкам и SOS-синтез ДНК, содержащей цис-син циклобутановые пиримидиновые димеры. Существуют и другие модели.
Полимеразная модель мутагенеза
В полимеразной модели мутагенеза считается, что единственной причиной образования мутаций являются спорадические ошибки ДНК-полимераз. Впервые полимеразная модель ультрафиолетового мутагенеза была предложена Бреслером. Он предположил, что мутации появляются в результате того, что ДНК-полимеразы напротив фотодимеров иногда встраивают некомплементарные нуклеотиды. В настоящее время такая точка зрения является общепринятой. Известно А-правило (A-rule), согласно которому напротив поврежденных участков ДНК-полимераза чаще всего встраивает аденины. Полимеразная модель мутагенеза объясняет природу мишенных мутаций замены оснований.
Таутомерная модель мутагенеза
Уотсон и Крик предположили, что в основе спонтанного мутагенеза лежит способность оснований ДНК переходить при некоторых условиях в неканонические таутомерные формы, влияющие на характер спаривания оснований
Эта гипотеза привлекала к себе внимание и активно развивалась. Обнаружены редкие таутомерные формы цитозина в кристаллах оснований нуклеиновых кислот, облученных ультрафиолетовым светом
Результаты многочисленных экспериментальных и теоретических исследований однозначно говорят о том, что основания ДНК могут переходить из канонических таутомерных форм в редкие таутомерные состояния. Было выполнено много работ посвященных исследованиям редких таутомерных форм оснований ДНК. С помощью квантовомеханических расчетов и метода Монте-Карло было показано, что таутомерное равновесие в цитозин — содержащих димерах и в гидрате цитозина сдвинуто по направлению к их имино формам как в газовой фазе, так и в водном растворе. На этой основе объясняется ультрафиолетовый мутагенез. В паре гуанин — цитозин устойчивым будет только одно редкое таутомерное состояние, в котором атомы водородов первых двух водородных связей, отвечающих за спаривание оснований, одновременно изменяют свои положения. А поскольку при этом изменяются положения атомов водорода, участвующих в Уотсон-Криковском спаривании оснований, то следствием может быть образование мутаций замены оснований, транзиций от цитозина к тимину или образование гомологичных трансверсий от цитозина к гуанину. Участие редких таутомерных форм в мутагенезе обсуждалось неоднократно.
Другие модели мутагенеза
В работах Полтева с соавторами предложен и обоснован молекулярный механизм узнавания полимеразами комплементарных пар оснований нуклеиновых кислот. На основании этой модели были изучены некоторые закономерности спонтанного и индуцированного аналогами оснований мутагенеза. Объяснено образование мутаций замены оснований в предположении, что главной причиной мутагенеза является образование неканонических пар оснований, типа Хугстиновских пар..
Предполагается, что одной из причин образования мутаций замены основания является дезаминирование 5-метилцитозина, что может вызывать транзиции от цитозина к тимину. Из-за дезаминирования цитозина напротив него в цепь ДНК может включаться урацил (образуется пара У-Г вместо канонической пары Ц-Г). При репликации ДНК напротив урацила в новую цепь включается аденин, образуется пара У-А, а при следующей репликации она заменяется на пару Т-А, то есть происходит транзиция (точечная замена пиримидина на другой пиримидин или пурина на другой пурин).
Кому это нужно?
Тем, у кого развилась резистентность опухоли или непереносимость ко всем препаратам из стандартного протокола лечения. Ситуация, когда «все перепробовали — не помогло».
В принципе, нынешние стандарты лечения, особенно европейские и американские протоколы (NCCN), которые мы применяем в «Медицине 24/7», обладают хорошим терапевтическим потенциалом — не зря они считаются «золотым стандартом» лечения в онкологии.
По этим стандартам, сначала назначают препараты 1-й линии терапии — те, что статистически лучше всего помогают при данном диагнозе. Смотрят динамику. Если опухоль не реагирует на лечение или — что хуже — прогрессирует — переходят к препаратам 2-й линии — тем, что по результатам исследований давали чуть менее успешное лечение. Если эти препараты тоже перестают помогать — идем к 3-й линии, и т. д. Многим пациентам длины этой «цепи» хватает до конца жизни.
Но регулярно, к сожалению, врачи оказываются в тупике: в ситуации, когда все линии «протокольной» терапии закончились, а пациент жив и прогрессирует. Коварство раковых опухолей — в их изменчивости. Они очень быстро мутируют дальше, и приспосабливаются к любым условиям, к любым препаратам. Для пациента это означает развитие резистентности — все препараты, прописанные в протоколах лечения, перестали действовать на его опухоль.
Нужно продолжать лечение — а у врача закончились «инструменты», предписанные официальными стандартами лечения. Есть другие препараты, есть право назначить их off-label, вне стандартных линий терапии. Но как узнать, какое лекарство выбрать?
В этом случае молекулярно-генетическое исследование и дает нам понимание, какой препарат будет эффективен против данной опухоли, именно с этим набором мутаций. Назначение такого препарата позволяет выиграть главный для онкопациента ресурс — время.
Как происходят мутации, и чем это грозит?
Ген ALK находится в коротком плече второй хромосомы, его локализация обозначается как 2p23:
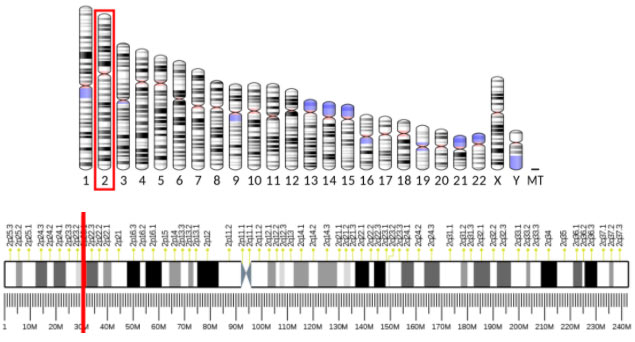
Определенные генетические изменения приводят к активации сигнального пути ALK и молекул, регулирующих клеточное деление. В настоящее время известно 826 генетических дефектов, в которых задействован ген ALK. 45 из них являются связанными с определенными патологиями или находятся «под подозрением». Патологическая активация пути ALK может происходить разными способами:
- Хромосомные перестройки с образованием химерных генов — когда из двух генов образуется новый. В частности, ALK может образовывать химерные гены с генами MSN, TPM4, CLTC, KIF5B, SQSTM1, NPM1, TFG, ATIC, RANPB2, EML4.
- Увеличение копий ALK.
- Мутации, при которых меняется последовательность «букв» генетического кода внутри гена ALK.
При онкологических заболеваниях в гене ALK встречаются как соматические, так и наследственные мутации.
Соматические мутации происходят в течение жизни только в некоторых клетках тела в результате воздействия определенных негативных факторов. Во время очередного деления клетки в хромосомах или структуре ДНК могут возникнуть ошибки. В результате нормальная клетка становится злокачественной.
Наследственные мутации передаются от родителей, происходят в половых клетках. В дальнейшем они присутствуют во всех клетках тела. У такого человека повышен риск развития определенных типов злокачественных опухолей, и он может передать генетический дефект потомству.
Насколько сильно повышается риск рака?
Рак молочной железы — самая распространенная «женская» злокачественная опухоль. По данным экспертов из США, это заболевание будет диагностировано в течение жизни у каждой восьмой женщины. У мужчин такая опухоль тоже может возникнуть, но риск намного ниже — 0,1% в течение жизни. При нарушенной функции генов BRCA риски существенно повышены.
При мутациях в BRCA1:
- Риск развития рака молочной железы у женщин к 70 годам: 44–78%.
- Риск развития рака молочной железы у мужчин к 70 годам: 0,22–2,8%.
При мутациях в BRCA2:
- Риск развития рака молочной железы у женщин к 70 годам: 31–56%.
- Риск развития рака молочной железы у мужчин к 70 годам: 3,2–12%.
Рак молочной железы, связанный с наследственными мутациями, составляет 5–10% от всех случаев. В 35% случаев за его развитие ответственны дефекты в гене BRCA1, в 25% случаев — в гене BRCA2.
Риск заболеть раком яичников в течение жизни для среднестатистической женщины составляет около 1,3%. При мутациях в гене BRCA1 он повышается до 18–54%, в гене BRCA2 — до 2,4–19%.
Примеры мутационной изменчивости в биологии
При затрагивании мутагеном малозначительного фрагмента ДНК в организме не произойдет никаких существенных изменений. «Память» ДНК будет передавать их последующим поколениям, однако со временем признаки могут навсегда исчезнуть.
При затрагивании важного фрагмента ДНК нарушается аминокислотная последовательность, а это влечет необратимые изменения внутри организма. Если такие изменения выявятся у большего количества особей, то эта мутация повлияет на характерные черты всего рода
Мутагенез представляет собой нарушение ДНК, его целостности, т.к. они наносят вред особям. Мутации могут сократить срок жизни организма, ухудшить его функциональность, привести к тяжелым заболеваниям.
Результаты мутагенеза, образованные в соматических клетках, не передаются по наследству. Однако после митотического деления, в процессе которого зарождаются новые клетки ткани, могут появиться уплотнения — опухоли. Мутации в половых клетках часто передаются последующим поколениям.
Пример
Мутация привела к укороченности крыльев у одной особи насекомого — у дрозофилы. Появление этого признака выявлено и у других представителей его вида. Ситуация для таких насекомых усложнится, если средой их обитания станет безветренная местность, т.к. их перемещение станет затруднительным.
Примеры мутаций у людей.