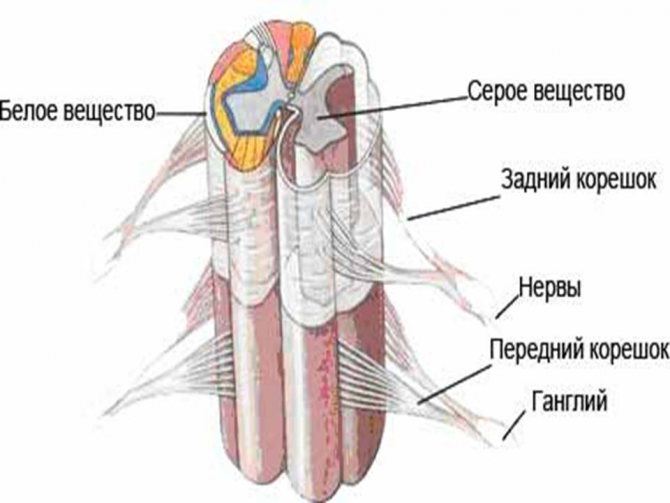
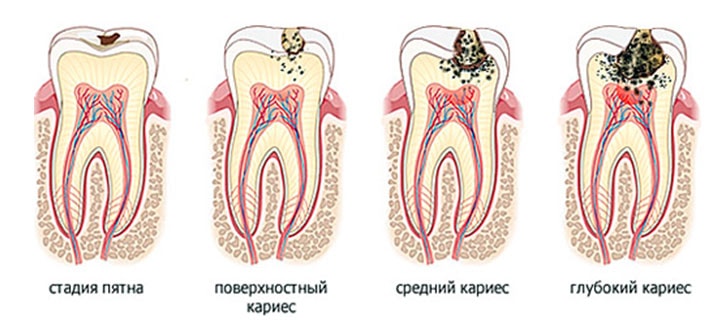
Противостояние с резистентными бактериями: наши поражения, победы и планы на будущее
Содержание:
- Правильно выбрасывать антибиотики
- FAQ об антибиотикорезистентности
- Лечение
- Почему устойчивость к противомикробным препаратам вызывает обеспокоенность во всем мире?
- Устойчивость к антибиотикам, связанная с хромосомными мутациями бактерий
- Источники
- Устойчивость к аминогликозидам
- Как делается анализ на чувствительность к антибиотикам
- Проблема антибиотикорезистентности
- Правильно применять антибиотики
- Сдерживание распространения антибиотикорезистентности
- Высокий уровень приоритетности
- Не требовать антибиотики у врача
- Средний уровень приоритетности
Правильно выбрасывать антибиотики
Главные причина загрязнения антибиотиками окружающей среды — их утечка с фармацевтических предприятий и использование в животноводстве. Но их правильная утилизация каждым человеком потенциально могла бы внести лепту в борьбу с антибиотикорезистентностью.
Насколько нам известно, сегодня в России нет способа выбросить антибиотики безвредно. Жителям Беларуси повезло больше: в Минске есть как минимум один специальный контейнер для приема просроченных лекарств. Во многих других странах есть возможность сдать ненужные лекарства на утилизацию. Сайт Recycle пишет, что некоторые лекарства можно попробовать отдать нуждающимся в них через специальные форумы и страницы в соцсетях. Там же указывают, что их можно пытаться пристроить знакомым из частных клиник, чтобы те оформили лекарства для утилизации с отходами своего медицинского учреждения.
FAQ об антибиотикорезистентности
Что такое антибиотикорезистентность?
О ней говорят, когда инфекции, которые ранее поддавались лечению определенным антибиотиком, начинают слабее реагировать на него или полностью теряют чувствительность к нему. Грибки, вирусы и паразиты также могут вырабатывать устойчивость, но в этой статье мы не фокусируемся на них.
Каковы причины устойчивости к антибиотикам?
Среди возможных причин роста устойчивости к антибиотикам:
- увеличение их использования
- их бесконтрольная продажа во многих странах
- их применение в животноводстве
- их утечка с фармацевтических заводов;
- широкое использование антисептиков.
Как развивается устойчивость к антибиотикам?
Чаще устойчивость к антибиотикам развивается в результате мутаций в генах бактерий. Бактерии, мутации которых позволяют сопротивляться антибиотикам, выживают и передают свои способности потомкам: происходит естественный отбор. Существует и горизонтальная передача генов: бактерии могут получать полезные гены от своих устойчивых к антибиотикам собратьев.
Как сопротивляются бактерии антибиотикам?
Бактерии могут:
- инактивировать или изменять структуру лекарств при помощи ферментов;
- менять свою структуру, делая невозможным действие антибиотика; — менять свой обмен веществ;
- снижать концентрацию лекарств внутри клетки. ##Что может сделать каждый из нас
Лечение
После культивирования бактерии следует определить, какой препарат окажется наиболее эффективным. В некоторых случаях можно использовать такие фторхинолоны, как энрофлоксацин, дифлоксацин или орбифлоксацин, однако возможна высокая степень резистентности к этим препаратам. Культивирование бактерий следует проводить с определением чувствительности к имипенему, а также второму (например, цефокситин) и третьему (цефотаксим) поколению цефалоспоринов, поскольку во многих случаях только эти препараты могут оказаться эффективными.
Существует несколько синтезируемых этими бактериями бета-лактамаз широкого спектра, которые способны инактивировать препараты первого и третьего поколения цефалоспоринов, однако оказываются бессильными перед препаратами второго поколения или имипенемом. Таким образом, исследования на чувствительность обеспечивают полный спектр возможного выбора лекарственных препаратов.
Поскольку большинство цефалоспоринов первого и третьего поколения, не говоря уже о карбапенемах, вводят только парентерально, постольку пероральное введение препаратов допустимо лишь в тех случаях, когда животных приходится лечить в домашних условиях. Цефиксим (Супракс) является одним из двух цефалоспоринов третьего поколения, допускающих пероральное назначение. Продается в виде жидкой суспензии и таблеток и назначается собакам в дозе 10 мг/кг каждые 12 часов.
Почему устойчивость к противомикробным препаратам вызывает обеспокоенность во всем мире?
Устойчивость к антибиотикам, связанная с хромосомными мутациями бактерий
Данный тип устойчивости связан с мутациями хромосомных генов, контролирующих транспорт антибиотиков в клетку или структуру и функцию тех клеточных компонентов, которые являются мишенью действия данного антибиотика. Многие антибиотики взаимодействуют с трансляционным аппаратом бактерии. Так, напр., тетрациклин, хлорамфеникол, пуромнцин взаимодействуют с аминоацил- тРНК, а стрептомицин и спектиномицин — с рибосомами. Поэтому устойчивость бактерий к перечисленным антибиотикам при не нарушенном их транспорте в клетку должна быть связана с мутациями в механизме белкового синтеза. Естественно, что большинство мутаций в аппарате трансляции у бактерий является для них летальными, что и объясняет относительно низкую частоту обнаружения в бактериальных популяциях мутантов, устойчивых к антибиотикам, блокирующим отдельные этапы синтеза белка.
Хромосомально контролируемая устойчивость к стрептомицину связана с мутациями, изменяющими 30S-субъединицу рибосомы. Оказалось, что рибосомы стрептомицин-резистентных бактерий не образуют комплекса с антибиотиком. Устойчивость к эритромицину, вероятно, зависит от изменения белков в 50S-субъединице рибосомы. С другой стороны, известно, что изменения в рибосомальной РНК, в частности нарушение ее метилирования, могут быть причиной возникновения устойчивости к антибиотику, напр, к касугамицину .
Пример хромосомально-детерминируемой устойчивости к антибиотикам, воздействующим на процесс транскрипции,— устойчивость бактерий к рифамицину, стрептоварицину и стрептолидигину. Бактерии, устойчивые к этим антибиотикам, несут хромосомные мутации в генах, контролирующих бета-субъединицу РНК-полимеразы, с к-рой взаимодействуют эти антибиотики.
Хромосомные мутации могут также вызывать устойчивость к пенициллину п его аналогам. Было установлено, что некоторые типы бактериальных мутантов, устойчивые к пенициллину, характеризуются изменениями в клеточных стенках, приводящими к повышенной осмотической чувствительности и к усилению выделения бета-лактамазы в среду. Этот тип устойчивости к пенициллину обнаруживается у бактерий, несущих мутацию в генах, контролирующих синтез липополисахаридов и галактозы, т. е. компонентов, входящих в клеточную стенку. Наиболее высоким уровнем устойчивости к пенициллину характеризуются бактериальные мутанты с такими изменениями поверхностных структур, которые сопровождаются потерей способности бактерий к конъюгации.
Источники
- Torre Monmany N., Astete JA., Ramaiah D., Suchitra J., Krauel X., Fillol M., Balasubbaiah Y., Alarcón A., Bassat Q. Extended Perinatal Mortality Audit in a Rural Hospital in India. // Am J Perinatol — 2021 — Vol — NNULL — p.; PMID:33902133
- Bellomo TR., Jeakle MA., Meyerhoff ME., Bartlett RH., Major TC. The Effects of the Combined Argatroban/Nitric Oxide-Releasing Polymer on Platelet Microparticle-Induced Thrombogenicity in Coated Extracorporeal Circuits. // ASAIO J — 2021 — Vol67 — N5 — p.573-582; PMID:33902103
- Stark A., Cantrell S., Greenberg RG., Permar SR., Weimer KED. Long-term Outcomes after Postnatal Cytomegalovirus Infection in Low Birthweight Preterm Infants: A Systematic Review. // Pediatr Infect Dis J — 2021 — Vol — NNULL — p.; PMID:33902071
- Solomon-Cohen E., Reiss-Huss S., Hodak E., Davidovici B. Low-Dose Acitretin for Secondary Prevention of Keratinocyte Carcinomas in Solid-Organ Transplant Recipients. // Dermatology — 2021 — Vol — NNULL — p.1-6; PMID:33902035
- Balakrishnan B., Payanam U., Laurent A., Wassef M., Athipettah J. Efficacy evaluation of anin situforming tissue adhesive hydrogel as sealant for lung and vascular injury. // Biomed Mater — 2021 — Vol — NNULL — p.; PMID:33902022
- Wei C., Sun Y., Wang J., Lin D., Cui V., Shi H., Wu A. LncRNA NONMMUT055714 acts as the sponge of microRNA-7684-5p to protect against postoperative cognitive dysfunction. // Aging (Albany NY) — 2021 — Vol13 — NNULL — p.; PMID:33902009
- Davis M., Johnson C., Pettit AR., Barkin S., Hoffman BD., Jager-Hyman S., King CA., Lieberman A., Massey L., Rivara FP., Sigel E., Walton M., Wolk CB., Beidas RS. Adapting Safety Check as a Universal Suicide Prevention Strategy in Pediatric Primary Care. // Acad Pediatr — 2021 — Vol — NNULL — p.; PMID:33901726
- Nissen LR., Tsamardinos I., Eskelund K., Gradus JL., Andersen SB., Karstoft KI. Forecasting military mental health in a complete sample of Danish military personnel deployed between 1992-2013. // J Affect Disord — 2021 — Vol288 — NNULL — p.167-174; PMID:33901697
- Yan H., Wu H., Xia Y., Huang L., Liang Y., Li Q., Chen L., Han Z., Tang S. Acquisition and transmission of HIV-1 among migrants and Chinese in Guangzhou, China from 2008 to 2012: Phylogenetic analysis of surveillance data. // Infect Genet Evol — 2021 — Vol — NNULL — p.104870; PMID:33901684
- Jimenez J., Paller AS. The Atopic March and its Prevention. // Ann Allergy Asthma Immunol — 2021 — Vol — NNULL — p.; PMID:33901675
Устойчивость к аминогликозидам
Аминогликозиды, используемые в клин. практике, могут быть инактивированы за счет одной из следующих реакций: ацетилирования, фосфорилирования или аденилирования, каждая из которых катализируется ферментами, контролируемыми генами, находящимися в составе R-плазмид (табл.)
Таблица. Ферменты, кодируемые плазмидами, модифицирующие аминогликозидные антибиотики
|
Ферменты, кодируемые плазмидами и модифицирующие |
Модифицируемые антибиотики |
|
3′-0-фосфотрансфераза |
Неомицин, канамицин |
|
3″-0-фосфотрансфераза |
Стрептомицин |
|
5″-0-фосфотрансфераза |
Рибостамицин |
|
2″-0-фосфотрансфераза |
Гентамицин |
|
2″-0-аденилтрансфераза |
Гентамицин, тобрамицин |
|
4′-0-аденилтрансфераза |
Амикацин, тобрамицин |
|
З»-0-аденилтрансфераза |
Стрептомицин, спектиномицин |
|
6′-0-аденилтрансфераза |
Стрептомицин |
|
6′-N-ацетилтрансфераза |
Амикацин, тобрамицин |
|
2′-N-ацетилтрансфераза |
Гентамицин, тобрамицин |
|
3′-N-ацетилтрансфераза |
Гентамицин,тобрамицин |
Предполагается, что ферменты, модифицирующие аминогликозидные антибиотики, локализованы в клетке на внутренней мембране, т. к. они могут быть освобождены в среду при отмывании холодной водой бактерий, обработанных сахарозой и трис-ЭДТА. Присутствие на внутренней мембране бактерий ферментов, модифицирующих аминогликозидные антибиотики, предотвращает, вероятно, их транспорт к рибосомам, представляющим мишень действия этих антибиотиков. С другой стороны, предполагалось, что модификация аминогликозидного антибиотика приводит к его инактивации. Накапливается все больше данных о возможной роли модифицирующих ферментов в нарушении транспорта аминогликозидных антибиотиков в клетку. Действительно, имеются результаты, указывающие, что полная инактивация антибиотика под влиянием модифицирующего фермента не наступает, а вместе с тем бактерия оказывается устойчивой к его действию. Уровень устойчивости к аминогликозидным антибиотикам, обусловленный R-плазмидами (см. R-фактор), колеблется от 20 до 5000 мкг/мл.
Эти колебания определяются многими причинами. Известно, что штаммы R+-бактерий, инактивирующие стрептомицин и канамицин путем фосфорилирования, характеризуются более высоким уровнем устойчивости к этим антибиотикам, чем этот же штамм, несущий другую плазмиду и инактивирующий антибиотики путем аденилирования. Различия в уровнях устойчивости к аминогликозидным антибиотикам могут быть обусловлены разным уровнем ферментативной активности, а именно: повышение последней может быть результатом увеличения в клетке числа копий плазмиды и, следовательно, числа генов, кодирующих модифицирующий фермент. Снижение уровня устойчивости к антибиотику может возникнуть в результате нарушения процесса выражения гена, определяющего устойчивость к данному антибиотику. Это часто наблюдают при переносе R-плазмиды из бактерии одного вида в бактерию другого вида. Расшифровка биохим, механизмов инактивации антибиотиков послужила стимулом для поиска новых препаратов, устойчивых к действию известных ферментов, определяющих резистентность бактерий. Так, напр., гентамицин, тобрамицин, ливидомицин А и Б активны в отношении бактерий, устойчивых к неомнцину и канамицину. Это определяется тем, что ферменты фосфорилирования, инактивирующие неомицин и канамицин, модифицируют 3′-OH группу аминогексозы, к-рая отсутствует в молекуле гентамицина и других упомянутых антибиотиков.
Как делается анализ на чувствительность к антибиотикам
Для анализа используется различный биологический материал – в зависимости от заболевания это может быть моча, кал, мазок (из влагалища, уретры, с задней стенки глотки), грудное молоко, мокрота, слюна, и т.д.
Анализ на чувствительность к антибиотикам относится к культуральным (микробиологическим) исследованиям. Поэтому другое его название – посев на чувствительность к антибиотикам.
Наибольшее распространение имеет диско-диффузный метод проведения анализа. В соответствии с данным методом патогенные микроорганизмы засеваются в питательную среду. Сверху накладываются диски, пропитанные антибиотиками. После чего посев помещается в термостат на 16-18 часов. Результат покажет, насколько тот или иной антибиотик способен справиться с данными бактериями.
В «Семейном докторе» для анализа чувствительности к антибиотикам используется также автоматический анализатор Vitek, обеспечивающий высокую стандартизацию и компьютеризацию исследования.автоматический анализатор
Проблема антибиотикорезистентности
Значение проблемы антибиотикорезистентности подтверждается многими исследованиями. Согласно данным, опубликованным в 2014 году, при сохраняющихся темпах роста антибиотикорезистентности суммарные потери общемирового ВВП к 2050 году составят более 100 триллионов долларов, а количество случаев преждевременной смерти людей в два раза превысит численность населения России .
Монорезистентные организмы становятся полирезистентными, а затем и панрезистентными. Появилось понятие так называемых “проблемных” микроорганизмов, среди которых особенно часто, особенно в условиях стационара, где широко применяются АМП и дезинфектанты, встречаются штаммы, резистентные к тем или иным (ко всем известным) АМП. К таким микроорганизмам относятся Staphylococcus spp., Enterococcus spp., Pseudomonas aeruginosa, Acinetobacter spp., ряд штаммов бактерий семейства Enterobacteriaceae.
Одной из наиболее важных причин сложившейся ситуации является доступность АМП населению во многих странах мира и высокая частота самолечения, которое очень часто является неадекватным. Так, по данным Европейского центра по профилактике и контролю заболеваний, около 40% европейцев уверены в том, что антибиотики эффективны при простуде и гриппе.
Свой вклад в усугубление проблемы, к сожалению, вносят и врачи. Недостаточная осведомленность клиницистов относительно правил рациональной АМТ, а иногда и неспособность устоять перед настойчивыми просьбами пациентов и их родителей приводят к неоправданному или неадекватному назначению АМП. Отсутствие просветительской работы с пациентами, в частности о необходимости завершения полного курса АМТ, становится причиной досрочного прекращения лечения. Все это способствует формированию и распространению устойчивых штаммов микроорганизмов.
Многими экспертами не раз уже отмечено, что хотя генерические препараты являются важным инструментом снижения общих затрат здравоохранения, по целому ряду из них отсутствуют адекватные исследования эффективности и безопасности по сравнению с оригинальными препаратами. Несколько исследований, проведенных в Российской Федерации, продемонстрировали наличие более низких концентраций активных субстанций в ряде “псевдогенериков”, что потенциально может приводить не только к снижению эффективности терапииу конкретного пациента, но и более быстрому росту резистентности к целому классу антибиотиков. В настоящее время рассматривается возможность внесения поправок к Федеральному закону №61. Согласно предложенным поправкам для регистрации новых генериков необходимо будет проводить исследование биоэквивалентности регистрируемого генерика по сравнению с оригинальным препаратом, а не любым уже зарегистрированным генериком.
Одной из основных проблем получения достоверных данных в бактериологических лабораториях России является недостаточно хорошее оснащение. Использование нестандартизированных сред и дисков с антибиотиками приводит к получению ложных результатов. В связи с этим значительное количество данных о чувствительности различных микроорганизмов к АМП не может быть использовано для проведения рациональной эмпирической АМТ
Следует также с осторожностью относиться к публикациям в отечественных и зарубежных источниках, в которых отсутствует информация о методах определения чувствительности и критериях интерпретации результатов. Необходимо помнить о том, что данные, полученные в зарубежных странах, могут существенно отличаться от российских, поэтому их нельзя использовать для выбора АМП.
Ситуацию также усугубляет недостаточный контроль за использованием АМП в ветеринарии и сельском хозяйстве. Применение антибиотиков в животноводстве в качестве добавки в корм для скота в малых дозах для стимулирования роста является общепринятой практикой во многих промышленно развитых странах и, как известно, приводит к повышению уровня резистентности микроорганизмов. Сельскохозяйственные животные могут служить резервуаром антибиотикорезистентных бактерий Salmonella spp., Campylobacter spp., Escherichia coli, Clostridium difficile, Staphylococcus aureus (MRSA), Enterococcus faecium (VRE) .
В настоящее время учитывая потенциальное развитие антибиотикорезистентности, АМП теряют коммерческую привлекательность, что находит подтверждение в отрицательной динамике появления новых системных антибиотиков (рис. 1).
Правильно применять антибиотики
Если врач назначил пациенту антибиотики, тот должен принимать их по предписанию и не прерывать курс лечения самостоятельно. Многие годы врачи утверждают, что преждевременная остановка лечения может вызвать устойчивость бактерий. В последнее время ученые указывали что это утверждение недостаточно обосновано научно. Это вызывало шквал новостей о том, что долгое время нам давали неправильные рекомендации обязательно завершать курс лечения даже при хорошем самочувствии.
Действительно, в настоящее время не для каждого случая ученые вычислили точную длительность продолжительности лечения. Кроме того, научных подтверждений тому, что устойчивость к антибиотикам развивается из-за досрочного прерывания лечения, в настоящее время практически нет. Но нужно помнить, что длительность курса лечения обусловлена не только вопросом устойчивости к антибиотикам. Улучшение самочувствия — далеко не всегда признак выздоровления. «Недобитая» инфекция может потребовать нового лечения антибиотиками. А то, что увеличение потребления антибиотиков ведет к устойчивости к ним, доказано совершенно точно. Нужно знать и то, что пропускать прием антибиотиков опасно. В этом случае их концентрация в организме падает.
Достоверно известно, что бактерии, развивающиеся под действием низких доз антибиотиков, которые не способны убить их, с большей вероятностью вырабатывают устойчивость. Да, все что их не убивает, делает их сильнее.
Сдерживание распространения антибиотикорезистентности
Антибиотики на сегодняшний день являются одной из самых часто применяющихся групп лекарственных средств. По данным Ассоциации международных фармацевтических производителей и ГК Ремедиум в 2014 году системные антибиотики в России занимали 4-е место в структуре амбулаторных и 2-е место в структуре госпитальных продаж готовых лекарственных средств.
Системные антибиотики в России, как и в большинстве развитых стран мира, относятся к лекарственным препаратам рецептурного отпуска, однако это требование далеко не всегда соблюдается. Недавнее исследование в рамках проводимой информационной кампании “Антибиотик надежное оружие, если цель бактериальная инфекция” показало, что 57% провизоров и фармацевтов аптечных учреждений Смоленска согласились продать антибиотик пациенту с симптомами острой респираторной инфекции без назначения врача. Более 60% опрошенных жителей Смоленска сообщили, что принимают антибиотики без назначения врача; у 38% опрошенных есть антибиотики в домашней аптечке. Таким образом, возможность свободного доступа стимулирует широкое использование антибиотиков населением для самолечения, что означает высокую вероятность их избыточного применения, ошибок при выборе препарата, дозы, длительности лечения.
В настоящее время во всем мире идет поиск альтернативных подходов к терапии инфекционных заболеваний. Одним из перспективных направлений в борьбе с инфекциями является применение бактериофагов и их компонентов. Бактериофаги природных штаммов и искусственно синтезированные генетически модифицированные фаги с новыми свойствами инфицируют и обезвреживают бактериальные клетки. Фаголизины – это ферменты, которые используются бактериофагами для разрушения клеточной стенки бактерий. Ожидается, что препараты на основе бактериофагов и фаголизинов позволят справиться с устойчивыми к АМП микроорганизмами, однако эти препараты появятся не ранее 2022-2023 гг. Параллельно с этим идет разработка препаратов на основе антибактериальных пептидов и вакцин для лечения инфекций, вызванных C. difficile, S. aureus, P. aeruginosa .
В последние годы резко возросла поддержка со стороны органов исполнительной и законодательной власти, а также Министерства здравоохранения Российской Федерации исследований, направленных на сдерживание антибиотикорезистентности. Так, например, Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии (МАКМАХ) и Федеральный научно-методический центр мониторинга резистентности к антимикробным препаратам активно занимаются разработкой страте гических направлений по данной проблеме.
На международный уровень обсуждение данной проблемы вышло на рубеже веков. В 2001 году ВОЗ опубликовала Глобальную стратегию по сдерживанию устойчивости к противомикробным препаратам, а в 2016 году вопрос борьбы с растущей угрозой антибиотикорезистентности был вынесен на повестку дня Генеральной Ассамблеи ООН.
Входящие в ООН государства в совместном заявлении обязались разработать национальные планы мер по противодействию устойчивости микроорганизмов к АМП. Это подразумевает усиление мониторинга лекарственноустойчивых инфекций и контроля за применением АМП в медицине, ветеринарии и сельском хозяйстве, а также укрепление международного сотрудничества и финансирования. Также члены организации взяли на себя обязательства ужесточить законодательное регулирование применения АМП, заниматься поиском рационального их использования (улучшение диагностики инфекций с учетом их чувствительности к препаратам) и широко внедрять меры профилактики инфекционных заболеваний (вакцинация, очистка воды, санитария, должный уровень гигиены в стационарах и на фермах) .
Высокий уровень приоритетности
- Enterococcus faecium
- Staphylococcus aureus
- Helicobacter pylori
- Campylobacter spp.
- Salmonellae
- Neisseria gonorrhoeae
Бактерии второй группы объединены по признаку повсеместного распространения, высокой социально-экономической значимости вызываемых ими заболеваний и быстрого развития резистентности к основным антибиотикам, используемым для их эрадикации, однако в резерве еще остается один или несколько эффективных препаратов.
Enterococcus faecium
E. faecium входит в состав нормальной микрофлоры кишечника, но в то же время является условно-патогенным микроорганизмом. У ослабленных больных может вызывать инфекции мочевыводящих путей, раневую инфекцию, сепсис и эндокардит. Резистентен к аминогликозидам, пенициллинам и цефалоспоринам. Беспокойство вызывает снижение чувствительности к ванкомицину — до 72 % в отдельных популяциях. Большинство штаммов E. faecium чувствительны к линезолиду, тигециклину, даптомицину.
Staphylococcus aureus
Золотистый стафилококк, колонизирующий кожу и слизистые оболочки, способен вызывать тяжелые инфекции кожи и мягких тканей, респираторные, раневые инфекции, остеомиелит, сепсис, артрит, эндокардит. Недавнее появление и распространение ванкомицин- и гликопептид-резистентных штаммов в дополнение метициллин-резистентному S. aureus значительно сужает выбор антибактериальных препаратов, однако у возбудителя сохраняется чувствительность к аминогликозидам, эритромицину, тетрациклину, ко-тримоксазолу, линезолиду.
Helicobacter pylori
Тревогу ВОЗ вызывает увеличение случаев резистентности всем известной H. pylori к кларитромицину, что сказывается на эффективности традиционных схем эрадикационной терапии, в том числе и в России. Перед эрадикацией ВОЗ рекомендует проверить чувствительность бактерии к этому антибиотику, при выявлении устойчивости — использовать схемы без него — с метронидазолом, тетрациклином или рифаксимином, а также добавлять висмута трикалия дицитрат.
Campylobacter spp.
Бактерии рода Campylobacter удерживают первое место в мире по гастроэнтеритам, которые у большинства населения планеты протекают в легкой форме, но представляют опасность для маленьких детей, беременных, стариков и иммунокомпрометированных больных. В большинстве случаев достаточно регидратации и восстановления электролитного баланса, антибактериальную терапию назначают при тяжелом течении. Проблемой является резистентность Campylobacter к фторхинолонам, основному средству борьбы с кишечной микрофлорой, и макролидам. Устойчивость к этим препаратам, впрочем, сильно варьирует от страны к стране — от менее 5 % в Финляндии до более 90 % в Индии. В Европе и России эритромицин всё еще остается препаратом выбора. По данным микробилогических исследований, в России также еще вполне актуальны фторхинолоны. В запасе для особо тяжелых случаев с осложнениями — гентамицин и карбапенемы.
Salmonellae
Представители рода сальмонелл также вызывают набор кишечных инфекций, от легкого энтерита до брюшного тифа. Большинство этих бактерий уже резистентны к бета-лактамам, аминогликозидам, тетрациклинам, хлорамфениколу и ко-тримоксазолу. Устойчивость к фторхинолонам растет во всем мире, но пока не привела к полной бесполезности этих препаратов, они остаются антибиотиками выбора, наравне с макролидами и цефалоспоринами третьего поколения. Антибактериальной терапии требуют только тяжелые случаи кишечных инфекций и, конечно, брюшной тиф и паратифы.
Neisseria gonorrhoeae
Гонорея из неприятной, но относительно легко излечимой болезни эволюционировала в глобальную медицинскую проблему. Гонококк потерял чувствительность к пенициллинам, тетрациклинам, сульфаниламидам и фторхинолонам.
Особое опасение вызывает появление и постепенное распространение штаммов, резистентных к цефалоспоринам (цефтриаксону), долгое время служивших безотказным средством борьбы с этой инфекцией. При резистентной к стандартным схемам лечения гонорее рекомендовано использовать комбинацию азитромицина с высокими дозами цефтриаксона. В России гонококк также практически резистентен к фторхинолонам, но пока сохраняет 100 %-ную чувствительность к цефтриаксону.
Не требовать антибиотики у врача
Даже профессионалы часто прогибаются под давлением пациентов и назначают то, что их просят. Чтобы оправдать ожидания родителей, они чаще выписывают антибиотики детям при ОРВИ. Аналогичные вещи распространены и во взрослой практике. Доказательства того, что антибиотики не помогают при вирусных заболеваниях дыхательных путей (в первую очередь, речь о бронхите) неоспоримы. В то же время, в США при симптомах бронхита с 1996 по 2010 год врачи назначали антибиотики в 70% случаев. Если при простудном заболевании, врач предлагает вам антибиотики, не бойтесь аккуратно попросить его обосновать назначение. Однако это не отменяет постулата, что назначениям врача нужно следовать.
Средний уровень приоритетности
- Streptococcus pneumoniae
- Haemophilus influenzae
- Shigella spp.
Третью группу также представляют широко распространенные бактерии, чья устойчивость к «обычным» антибиотикам пока не приняла угрожающих масштабов, однако чревата большими проблемами в будущем.
Streptococcus pneumoniae
Пневмококки — одни из основных возбудителей инфекций ЛОР-органов, внебольничной пневмонии, менингита. Резистентны к тетрациклину и ко-тримоксазолу. В мире постепенно снижается чувствительность S. pneumoniae к бета-лактамам и макролидам, однако, как и в других случаях, доля резистентных штаммов сильно варьирует от страны к стране. В России большинство штаммов пневмококков, к счастью, всё еще чувствительны к пенициллинам и макролидам, также эффективны хлорамфеникол, рифампицин, левофлоксацин, ванкомицин.
Haemophilus influenzae
Гемофильная инфекция у детей младшего возраста протекает в виде бактериемии, гнойного менингита, пневмонии, целлюлита и эпиглоттита, у взрослых — в основном в виде пневмонии. Тревогу ВОЗ вызывает развитие полной резистентности гемофильной палочки к ранее эффективному ампициллину, в результате чего от него пришлось повсеместно отказаться. В России эффективны амоксициллин, цефалоспорины и макролиды, однако рекомендуется проводить бактериологический анализ с оценкой резистентности.
Shigella spp.
Возбудители дизентерии практически не чувствительны к ампициллину. Как и прочие энтеробактерии, они также постепенно вырабатывают устойчивость к фторхинолонам, которые тем не менее всё еще остаются препаратами выбора. В качестве альтернативы — цефалоспорины III поколения, ко-тримоксазол.