Глиозные изменения головного мозга
Содержание:
- Суть процесса
- Хирургические вмешательства
- К какому врачу обратиться
- Триггеры глиоза
- Глиомы высокой степени злокачественности (GRADE III-IV)
- Глиоз головного мозга: причины
- Классификация глиом головного мозга
- Распространенные заболевания
- Астроглиоз
- Симптомы глиомы головного мозга
- Определение патологии
- Симптоматическое лечение и реабилитация
- Клинические формы активной рецидивирующей ЭБВ-инфекции с формированием
- Симптомы глиоза головного мозга
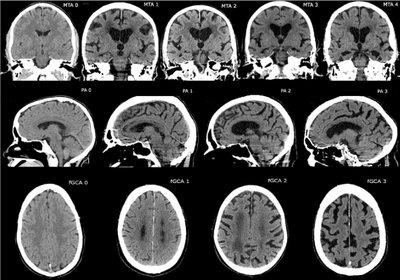
- Диагностика
- Диагностика
Суть процесса
Глиоз поражает нервные ткани в результате запуска особого механизма – при повреждении мозга. Клетки и волокна глии замещают утраченные нейроны. Происходят вторичные кистозно-глиозные изменения. Когда глия разрастается, очаги повреждения изолируются, создается защита неповрежденных тканей. Кистозно-глиозные изменения головного мозга напоминают рубцевание раны.
Величина поражения может быть разной. При расчете этого показателя учитывают соотношение доли разросшейся глии к клеткам ЦНС в единице объема. Если развивается глиоз головного мозга, прогноз зависит от степени разрастания участков поражения. Этот патологический процесс может вызвать серьезные нарушения функций мозга. Вылечить его невозможно. Если установить генез, можно замедлить или приостановить развитие болезни.
Хирургические вмешательства
В большинстве случаев основным методом лечения глиом является хирургическое вмешательство. Его объем зависит от расположения и размеров опухоли. Если новообразование небольшое, и его можно легко отделить от окружающих тканей, то его удаляют полностью. Зачастую глиому сложно выделить из ткани мозга, или она прилегает к важным нервным центрам, которые можно случайно повредить. В таких случаях выполняют циторедуктивную операцию, во время которой стараются удалить как можно большее количество опухолевой ткани.
Глиома — опухоль, которая находится в замкнутом пространстве, полости черепа. Она сдавливает соседние ткани, приводит к повышению внутричерепного давления. Из-за этого пациент испытывает такие симптомы, как головные боли, которые не получается снять обезболивающими препаратами, тошнота, рвота, судороги. В зависимости от того, какие нервные центры затронуты, возникают различные неврологические расстройства. Даже если опухоль не удалось удалить полностью, уменьшение ее объема после циторедукции поможет уменьшить эти симптомы, повысить качество жизни пациента.
Чтобы определить оптимальный объем удаляемой опухолевой ткани, не затрагивая здоровую ткань, хирурги применяют различные методики:
- Интраоперационная биопсия. Гистологическое исследование опухолевой ткани выполняют прямо во время хирургического вмешательства.
- Интраоперационная магнитно-резонансная томография.
- Операция во время бодрствования пациента. В головном мозге нет болевых рецепторов, поэтому наркоз не обязателен. Во время такого хирургического вмешательства врачи периодически просят больного совершать различные действия, чтобы убедиться, что не повреждены важные нервные центры.
- Нейрофизиологический мониторинг — контроль электрической активности мозга в режиме реального времени.
Помимо удаления опухоли и борьбы с симптомами, цель операции при опухолях мозга — получить необходимое количество опухолевой ткани для гистологического исследования. Это помогает уточнить диагноз и спланировать дальнейшую оптимальную лечебную тактику.
Если опухоль мозга невозможно удалить, или это нецелесообразно, биопсия может быть выполнена отдельно. В очень редких случаях лучевую терапию и химиотерапию начинают без гистологического исследования. Например, такое решение может быть принято у сильно ослабленных пациентов, при выраженных неврологических расстройствах, если опухоль находится в жизненно важных структурах.
К какому врачу обратиться
При подозрении на наличие глиоза необходимо обратиться к неврологу. После проведенных исследований для подтверждения диагноза и определения тактики лечения могут потребоваться консультации у специалистов:
- кардиолога – при подозрении на глиоз сосудистого генеза;
- терапевта или семейного врача – для определения хронических болезней;
- эндокринолога – при сахарном диабете;
- нейрохирурга – при необходимости оперативного лечения.
У детей заподозрить развитие глиальных изменений на протяжении первого месяца после рождения может неонатолог. Позже изменения в развитии выявляет педиатр, который направит ребенка на консультацию детского невролога.
Триггеры глиоза
Обычно после любого поражения ЦНС глиоз начинается после того, как гематоэнцефалический барьер нарушается, позволяя молекулам, не относящимся к ЦНС, таким как компоненты крови и сыворотки , проникать в мозг. Эти компоненты, наряду с активированными макрофагами, которые они несут, как известно, играют роль в начале формирования глиального рубца, вызывая отключение аксонов, также называемое вторичной аксотомией, и активацию компонентов фиброзного внеклеточного матрикса, которые в конечном итоге образуют рубцовую ткань. . Однако конкретные молекулярные триггеры, ответственные за это действие, остаются неизвестными. Одним из потенциальных триггеров является трансформирующий фактор роста β (TGF-β). Было показано, что TGF-β2 , экспрессия которого постепенно увеличивается по мере возникновения глиоза, увеличивает продукцию астроцитами шрамообразующих протеогликанов. Экспериментальное снижение как TGF-β2, так и TGF-β1 , которое экспрессируется сразу после травмы, привело к уменьшению глиального рубцевания. Интерлейкины — еще один потенциальный молекулярный триггер глиоза. Эти молекулы, особенно ИЛ-1, инициируют воспалительную реакцию в различных клетках, включая астроциты, которые вносят вклад в реакцию глиоза. Наконец, взаимодействия между воспалительными цитокинами, интерфероном-γ (IFN-γ) и фактором роста фибробластов 2 (FGF2) также могут быть ответственны за индукцию глиоза. В культуре обе молекулы действуют как митогены , вызывая пролиферацию астроцитов. Более того, добавление IFN-γ к участкам поражения головного мозга привело к увеличению рубцевания глии.
Глиомы высокой степени злокачественности (GRADE III-IV)
Глиомы высокой степени злокачественности (ГВСЗ) Grade III-IV — анапластическая астроцитома, анапластическая олигоастроцитома, анапластическая олигодендроглиома и мультиформная глиобластома, глиосаркома являются наиболее часто встречающимися первичными злокачественными опухолями головного мозга у взрослых 60-70%.
Существует два пика заболеваемости злокачественными глиальными опухолями головного мозга, первый между 0 и 4 годами. В это время опухоли ЦНС занимают второе место среди злокачественных новообразований детского возраста, составляя среди них 14-20% и уступая только лимфомам и лейкозам. Второй пик заболеваемости находится между 35 и 75 годами. В этом периоде злокачественные глиомы головного мозга – третья, наиболее частая причина смерти от онкологических заболеваний у мужчин и четвертая по частоте у женщин в экономически развитых странах.
Современные принципы лечения злокачественных глиом головного мозга предполагают, прежде всего, хирургическое удаление опухоли с последующей адъювантной терапией. Хирургия является одним из основных методов лечения данной категории пациентов так как, прежде всего, способствует определению морфологического диагноза и устраняет неблагоприятные симптомы заболевания.
Несмотря на совершенствование хирургического оборудования отдаленные результаты только оперативного лечения больных злокачественными глиомами головного мозга на сегодняшний день остаются неутешительными, в связи с высокой частотой локальных и отдаленных рецидивов, которые наблюдаются в 70-80% случаев.
Проведение в послеоперационном периоде лучевой и/или химиолучевой терапии у больных ГВСЗ, позволяет улучшить результаты лечения, снижая частоту рецидивов, улучшая качество жизни и увеличивая продолжительность жизни на сроки более 5 лет.
Глиоз головного мозга: причины
В норме клетки глии несут обслуживающую функцию для нейронов, и обеспечивают проводимость нервных импульсов, реализовывая метаболизм и основывая условия формирования нервных тканей.
Как уже говорилось ранее, основной причиной развития глиоза является повреждение нейронов в результате патологического процесса.
Нередко в результате ишемического инсульта возникает постишемический глиоз головного мозга. Провоцирующим фактором постишемического глиоза служит длительно текущая гипертония или резко возникший инсульт в результате какого-либо воздействия.
Периваскулярный глиоз может развиться при воспалительных или склеротических процессах в сосудах.
Причинами глиоза могут быть гипоксемия (пониженное содержание в крови кислорода), анемия, гипогликемия (снижение уровня глюкозы в крови), пониженное кровообращение, травмы, отеки мозга и пр. нарушения.
Кроме того отмечается возникновение глиоза как наследственной патологии жирового обмена. В результате чего поражается нервная система. Ярким выражением подобной патологии является болезнь Гея-Сакса, часто возникающая при репродукции потомства от брака близких родственников.
Помимо этого, выявлено, что процессы старения разрушают нейроны, и они заменяются на глии, при этом формируются губчатые структуры, влекущие такие проблемы старости как нарушение памяти, координации движений и замедление реакции.
Классификация глиом головного мозга
Различают три основных вида глиом головного мозга:
- астроциты;
- эпендимоциты;
- олигодендроглиоциты.
В зависимости от разновидности клеток, из которых начинается развитие глиомы головного мозга, говорят о астроцитоме (50% случаев всех глиом), эпендимоме (не более 8% случаев от общего числа заболевания) и олигодендроглиоме (около 10% случаев).
На практике случаются и смешанные типы глиом, а также различные виды опухолей на основе сосудистого сплетения. Они могут быть неясного происхождения.
В неврологии выделяют 4 степени злокачественной глиомы головного мозга:
- Медленно растущая глиома доброкачественного характера (например, ювениальная или гигантоклеточная астроцитомы);
- Пограничная глиома — злокачественная опухоль, которой характерен медленный рост. Злокачественность данной степени можно определить только по одному признаку — по клеточной атипии. Именно такая глиома трансформируется в третью и четвертую степень.
- Третья степень злокачественности представлена двумя признаками: фигурой митозов, микропролиферацией (или как вариант, ядерной атипией).
- Четвертой степени злокачественности присущ некроз в виде мультиформной глиобластомы.
Если классифицировать глиомы по локализации, то говорят о:
- субтенториальных (расположенных ниже мозжечка);
- супратенториальных (расположенных выше от места мозжечка).
Распространенные заболевания
Рассеянный склероз – демиелинизирующее, аутоиммунное заболевание с хроническим течением, поражающее главные элементы нервной системы (головной и спинной мозг). В ходе прогрессирования патологии происходит замещение нормальных мозговых структур соединительной тканью. Очаги появляются диффузно. Средний возраст пациентов составляет 15-40 лет. Распространенность – 30-70 случаев на 100 тысяч населения.
Геморрагический лейкоэнцефалит, протекающий в острой форме, развивается вследствие повреждения мелких элементов сосудистой системы. Часто определяется как постинфекционное осложнение с выраженной аутоиммунной реакцией. Характеризуется быстрым прогрессированием воспалительного процесса и многочисленными очаговыми поражениями мозговой ткани, сопровождается отеком мозга, появлением очагов кровоизлияния, некрозом.
Предшественником патологии обычно являются заболевания верхних дыхательных путей инфекционной этиологии. Спровоцировать болезнь также могут вирусы гриппа и Эпштейна-Барр или сепсис. Обычно приводит к летальному исходу. Смерть наступает из-за отека мозга в течение 3-4 дней с момента появления первых симптомов.
Для некротизирующей энцефалопатии, протекающей в острой форме, свойственно многоочаговое, симметричное поражение структур головного мозга демиелинизирующего характера. Сопровождается отеком тканей, некрозом и возникновением очагов геморрагии. В отличие от геморрагического лейкоэнцефалита, не обнаруживаются клетки, указывающие на воспалительный процесс – нейтрофилы.
Часто развивается на фоне вирусной инфекции, проявляется эпилептическими припадками и помрачением сознания. В цереброспинальной жидкости отсутствует плеоцитоз (аномально повышенная концентрация лимфоцитов), увеличена концентрация белковых соединений. В сыворотке крови выявляется повышенная концентрация аминотрансферазы. Развивается спорадически (единично) или вследствие наследственной генной мутации.
Псевдотуморозная демиелинизация проявляется общемозговой и очаговой церебральной симптоматикой. В 70% случаев сопровождается отеком мозгового вещества с повышением значений внутричерепного давления. Очаги демиелинизации обнаруживаются в белом веществе в ходе исследования МРТ головного мозга с использованием контрастного вещества.
Склероз Бало (концентрический) проявляется болями в области головы, патологическим изменением поведения, когнитивными расстройствами, эпилептическими приступами, гемисиндромами (неврологические нарушения в одной половине тела). Течение патологии клинически напоминает развитие внутримозговой опухоли. Очаги поражения ткани чаще наблюдаются в белом веществе.
В цереброспинальной жидкости обнаруживается лимфоцитарный плеоцитоз, повышенная концентрация белковых соединений. Нередко наблюдается присутствие олигоклональных антител в меньшем количестве, чем при обычном рассеянном склерозе. МРТ-исследование показывает типичные для рассеянного склероза .
На снимках отчетливо видны множественные кольцевидные очаги демиелинизации в белом веществе, чаще в лобных долях головного мозга, окруженные характерными участками ремиелинизации (восстановления нормального миелина). В большинстве случаев наступает летальный исход в течение нескольких недель или месяцев острого течения патологии. При ранней диагностике прогноз более благоприятный.
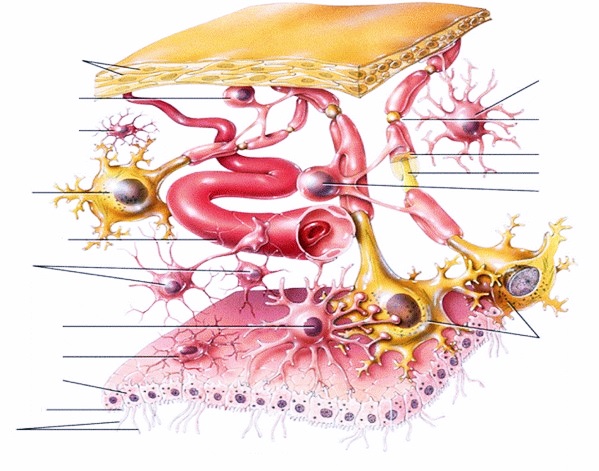
Астроглиоз
Микрофотография, показывающая глиоз мозжечка. Реактивные астроциты слева демонстрируют сильную пролиферацию и перекрытие доменов.
Реактивный астроглиоз является наиболее распространенной формой глиоза и включает в себя пролиферацию из астроцитов , тип глиальных клеток , ответственных за поддержание внеклеточных ионов и нейротрансмиттер концентрации, модулируя синапсы функции, и формирование гематоэнцефалического барьера . Как и другие формы глиоза, астроглиоз сопровождает черепно-мозговую травму, а также многие нейропатологии, от бокового амиотрофического склероза до фатальной семейной бессонницы . Хотя механизмы, которые приводят к астроглиозу, до конца не изучены, хорошо известно, что повреждение нейронов вызывает пролиферацию астроцитов, и астроглиоз долгое время использовался в качестве показателя повреждения нейронов. Традиционно астроглиоз определяли как увеличение промежуточных филаментов и клеточную гипертрофию, а также увеличение пролиферации астроцитов. Хотя эта и разрастание в их крайней форме наиболее тесно связаны с формированием глиального рубца , астроглиоз не является комплексным процессом, при котором формируется глиальный рубец. Фактически, это спектр изменений, которые происходят в зависимости от типа и тяжести повреждения центральной нервной системы (ЦНС) или заболевания, вызвавшего событие. Изменения функции или морфологии астроцитов, которые происходят во время астроглиоза, могут варьироваться от незначительной гипертрофии до большой гипертрофии, перекрытия доменов и, в конечном итоге, образования глиальных рубцов. Тяжесть астроглиоза классически определяется уровнем экспрессии глиального фибриллярного кислого белка (GFAP) и виментина , оба из которых активируются при пролиферации активных астроцитов.
Модуляция астроглиоза
Изменения астроглиоза регулируются контекстно-зависимым образом, и сигнальные события, которые диктуют эти изменения, могут изменять как их характер, так и тяжесть. Именно эти изменения в астроглиозе делают процесс сложным и многогранным, включая как усиление, так и потерю функции, а также как положительные, так и отрицательные эффекты. На реактивные астроциты влияют молекулярные сигналы, испускаемые различными типами клеток ЦНС, включая нейроны, микроглию , клетки-предшественники олигодендроцитов , лейкоциты, эндотелии и даже другие астроциты. Некоторые из многих сигнальных молекул, используемых в этих путях, включают цитокины интерлейкин 6 (IL-6) , цилиарный нейротрофический фактор (CNTF) и фактор ингибирования лейкемии (LIF) . Хотя многие из этих специфических модуляторных отношений еще полностью не изучены, известно, что различные специфические сигнальные механизмы приводят к различным морфологическим и функциональным изменениям астроцитов, позволяя астроглиозу принимать градуированный спектр степени тяжести.
Последствия астроглиоза
Хотя астроглиоз традиционно рассматривался как отрицательный ответ, тормозящий регенерацию аксонов , этот процесс очень консервативен, что позволяет предположить, что он имеет важные преимущества, помимо пагубных последствий. Как правило, последствия астроглиоза варьируются в зависимости от контекста начального поражения ЦНС, а также от времени после травмы. Ниже перечислены некоторые из наиболее важных эффектов астроглиоза.
Благоприятные эффекты
- Нейропротекторные эффекты — реактивные астроциты выделяют нейротрофические факторы , такие как нейротрофический фактор глиальных клеток (GDNF) , который защищает от запрограммированной гибели клеток.
- Поддержание внеклеточной среды — астроциты отвечают за поглощение глутамата , что ограничивает эксайтотоксичность нейронов и других типов клеток, а также устраняет свободные радикалы.
- Высвобождение противовоспалительных молекул
- Восстановление функции гематоэнцефалического барьера
- Изоляция места повреждения и сдерживание инфекции от здоровой ткани
Вредные эффекты
- Ограничение регенерации аксонов — В случаях формирования глиальной рубцовой, реактивные астроциты улавливают поражения сайт и хранение ингибирующее внеклеточный матрикс , состоящий из хондроитинсульфат протеогликанов . Плотная структура этих белков является физически и химически препятствующим барьером для регенерации аксонов и восстановления связей аксонов.
- Секреция нейротоксических веществ — они могут включать провоспалительные и цитотоксические цитокины . Примеры этих молекул включают радикалы оксида азота и TNF-α .
- Высвобождение эксайтотоксического глутамата
- Препятствие функциональному восстановлению и ухудшение клинических проявлений
Симптомы глиомы головного мозга
Глиома головного мозга может иметь различную симптоматику, которая зависит, в первую очередь, от локализации опухоли. Часто встречается общая симптоматика:
- головные боли, которые не проходят даже после принятия сильно действующих обезболивающих;
- чувство тяжести в области глазных яблок;
- рвота;
- тошнота;
- судороги.
Характерную яркую выраженность данная симптоматика приобретает в случае прорастания глиомы по ликворным путям или в полость желудочков. При нарушении циркуляции жидкости цереброспинального типа, происходит ее отток, что приводит к гидроцефалии с дальнейшим повышением внутричерепного давления.
Среди других симптомов глиомы головного мозга:
- вестибулярная атаксия, подразумевающая нарушение координации движения при ходьбе, головокружение системного типа;
- нарушение зрения;
- невнятность речи;
- снижение мышечной активности;
- возникновение парезов, параличей;
- снижение чувствительности (поверхностного и глубокого типов);
- психические отклонения (снижение мышечной активности, нарушение памяти).
Определение патологии
Когда нейроны, составляющие нервную ткань, повреждаются, на их месте образуются клетки глии. Глиозные изменения – это такой процесс, протекающий в головном мозге, который характеризуется увеличением количества клеток глии, что при расширении масштабов замещения приводит к ухудшению функционирования ЦНС. Чем больше глиозных очагов в мозговом веществе, тем хуже головной мозг выполняет свои функции.
Нарушения чаще связаны с ухудшением передачи нервных импульсов, при помощи которых нервная система управляет органами и системами организма. Пролиферация глиальных клеток чаще протекает в виде диффузного распространения астроцитов. В ходе разрастания участков, состоящих из клеток глии, появляются такие признаки патологии, как нарушение двигательной координации, ухудшение памяти, замедленность движений и реакции. Глиозная трансформация головного мозга в зависимости от вида первичной патологии протекает с характерными особенностями.
При сахарном диабете наблюдается масштабная инфильтрация макрофагов и гипертрофия (патологическое увеличение размеров) астроцитов. Глиозные изменения у больных наркоманией сопровождаются увеличением числа олигодендроцитов дренажных форм. При рассеянном склерозе выявляется гипертрофия астроцитов и изменение глиальной формулы (астроциты – 46%, олигодендроциты – 40%, другие клетки – 14%).
В норме глиальная формула выглядит так: астроциты – 8,5%, олигодендроциты – 85%, другие клетки – 7,5%. При эпилепсии наблюдается уменьшение количества олигодендроцитов на 20% и микроглиоцитов на 6%. Глиальные клетки являются самыми многочисленными и активными компонентами мозговой ткани. Они сохраняют способность делиться на протяжении всей жизни. Благодаря высокой активности клетки глии незамедлительно реагируют на любые изменения условий функционирования мозга.
Среднее количество клеток в 1 мм2 мозговой ткани различается в зависимости от месторасположения участка. К примеру, в теменной доле количество клеток в 2 раза больше, чем в лобном отделе. При диагнозе рассеянный склероз количество клеток глии на участках, не затронутых процессом демиелинизации, может увеличиваться примерно в 3 раза. У больных наркоманией доля глиальных клеток возрастает примерно в 2 раза.
При дисциркуляторной энцефалопатии этот показатель увеличивается незначительно. Очаги глиоза возникают как реакция нейроглии на повреждение нервной ткани или изменение условий функционирования мозга. Митотическая активность глиоцитов повышается в ответ на развитие патологических процессов в тканях ЦНС. Глиозные очаги – следствие процесса восстановления разрушенной мозговой ткани. Однако функции участков восстановленной ткани не всегда адекватны нормальным физиологическим процессам.
Причина неполного соответствия функций кроется в недоразвитости глиальных клеток, которые, не достигнув зрелости и нормального уровня функционирования, подвергаются апоптозу (регулируемый процесс клеточной гибели). Наиболее ярко подобные явления наблюдаются при рассеянном склерозе. Для человека опасен не сам процесс глиальных трансформаций, сколько его масштабы и незавершенность, связанная с прерыванием нормального развития глиоцитов.
Симптоматическое лечение и реабилитация
Помимо борьбы со злокачественной опухолью, важно купировать симптомы, обеспечить удовлетворительное состояние и качество жизни пациента. По показаниям назначают глюкокортикостероиды для уменьшения отека мозга и купирования головных болей, дегидратационную терапию (направленную на уменьшение внутричерепного давления и отека мозга), противосудорожную терапию, антикоагулянты
Глиомы нередко нарушают функцию нервных центров, отвечающих за речь и движения. В таких случаях после завершения лечения пациентам необходимы реабилитационные мероприятия: лечебная физкультура, механотерапия, эрготерапия, занятия с логопедом.
Клинические формы активной рецидивирующей ЭБВ-инфекции с формированием
- адено-тонзиллярного синдрома,
- ЛАП (лимфаденопатия),
- интерстициальной пневмонии,
- лихорадки,
- поражения ЖКТ, ЦНС,
- васкулита,
- миокардита,
- нефрита,
- цитопении,
- гемофагоцитарного синдрома
Гемофагоцитарный синдром
Гемофагоцитарный синдром развивается в результате пролиферации и гиперактивации клеток СМФ с развитием гемофагоцитоза в костном мозге на фоне тяжелой бактериально-грибковой инфекции, протекающей на фоне ЭБВ персистенции, аутоиммунной цитопении.
В крови наблюдается: анемия, лимфомоноцитоз, тромбоцитопения, лейкопения Сопутствуют гепатоспленомегалия, при этом повышен уровень ферритина, что сопровождается лихорадочным состоянием, токсикозом и др. симптомами тяжелого состояния.
Фагоцитоз макрофагами форменных элементов крови
Развитие коронарита (вне синдрома Кавасаки) после острой и чаще на фоне хронически текущей ЭБВ-инфекции.
Симптомы глиоза головного мозга
Глиоз обычно выявляется при томографии мозга во время обследования. К выраженным симптомам глиоза головного мозга относятся частые головные боли, резкие перепады артериального давления, паралич.
Симптомами глиоза головного мозга у новорожденных служат потеря сознания, нарушения зрения и слуха, судороги и неспособность глотать пищу.
У детей первые проявления кинической картины возникают примерно на 4-6 месяце жизни. В этот период болезнь прогрессирует настолько, что ребенок становиться полностью безучастным к окружающим и перестает развиваться. В данном случае наследственный механизм приводит ребенка к гибели в течение 2 лет.
Диагностика
Для диагностики демиелинизирующих заболеваний используются различные методы / приемы:
- Исключение других состояний с частично совпадающими симптомами
- Магнитно-резонансная томография (МРТ) — это метод медицинской визуализации , используемый в радиологии для детальной визуализации внутренних структур тела. МРТ использует свойство ядерного магнитного резонанса (ЯМР) для изображения ядер атомов внутри тела. Этот метод надежен, потому что МРТ оценивает изменения в плотности протонов. «Пятна» могут возникать в результате изменения содержания воды в головном мозге.
- Вызванный потенциал — это электрический потенциал, регистрируемый нервной системой после предъявления стимула, обнаруживаемый электроэнцефалографией (ЭЭГ), электромиографией (ЭМГ) или другим методом электрофизиологической записи.
- Анализ спинномозговой жидкости (ЦСЖ) может быть чрезвычайно полезным при диагностике инфекций центральной нервной системы. СМЖ культура исследование может дать в микроорганизм , который вызвал инфекцию.
- Количественная протонная магнитно-резонансная спектроскопия (MRS) — это неинвазивный аналитический метод, который использовался для изучения метаболических изменений при опухолях мозга, инсультах, судорожных расстройствах, болезни Альцгеймера, депрессии и других заболеваниях, поражающих мозг. Он также использовался для изучения метаболизма других органов, таких как мышцы.
- Диагностические критерии относятся к определенной комбинации признаков, симптомов и результатов анализов, которые врач использует для определения правильного диагноза.
- Восстановление инверсии с ослаблением жидкости (FLAIR) использует последовательность импульсов для подавления спинномозговой жидкости и более четкого отображения поражений и используется, например, при оценке рассеянного склероза.
Типы
Демиелинизирующие заболевания можно разделить на заболевания, поражающие центральную нервную систему (ЦНС), и заболевания, поражающие периферическую нервную систему (ПНС). Также их можно классифицировать по наличию или отсутствию воспаления . Наконец, разделение может быть выполнено на основе первопричины демиелинизации: болезненный процесс может быть демиелинизирующим миелинокластом , при котором миелин разрушается; или дисмиелинизирующий лейкодистрофический , при котором миелин является аномальным и дегенеративным.
ЦНС
Демиелинизирующие расстройства центральной нервной системы включают:
- Миелинокластические или демиелинизирующие расстройства:
- Типичные формы рассеянного склероза
- Оптический невромиелит или болезнь Девика
- Идиопатические воспалительные демиелинизирующие заболевания
- Лейкодистрофические или дисмиелинизирующие расстройства:
- ЦНС невропатия , такие как те , которые получают витамин B 12 дефицита
- Центральный миелинолиз моста
- Миелопатии, такие как tabes dorsalis (сифилитическая миелопатия)
- Лейкоэнцефалопатии, такие как прогрессирующая мультифокальная лейкоэнцефалопатия
- Лейкодистрофии
Миелинокластические расстройства обычно связаны с такими симптомами, как неврит зрительного нерва и поперечный миелит , поскольку демиелинизирующее воспаление может поражать зрительный нерв или спинной мозг . Многие из них идиопатические . И миелинокластический, и лейкодистрофический формы заболевания могут приводить к демиелинизации пораженных участков центральной нервной системы .
ПНС
Синдром Гийена-Барре — демиелинизация
К демиелинизирующим заболеваниям периферической нервной системы относятся:
- Синдром Гийена-Барре и его хронический аналог, хроническая воспалительная демиелинизирующая полинейропатия
- Анти-MAG периферическая нейропатия
- Болезнь Шарко – Мари – Тута и ее аналог Наследственная невропатия со склонностью к параличу от сдавления.
- Состояния, связанные с дефицитом меди ( периферическая нейропатия , миелопатия и редко оптическая нейропатия )
- Прогрессирующая воспалительная невропатия
Диагностика
Чтобы поставить верное заключение, требуется тщательное и всестороннее обследование. Цель его – проанализировать признаки и выявить источники энцефалопатии.
На консультации рассматривается анамнез, пациент опрашивается, изучаются рефлексы, нарушения движений, памяти, уровня интеллекта, а также разбирается самочувствие больного.
Измеряют артериальное давление и назначают определенные исследования, в частности у других специалистов. Например, анализ липидного спектра обеспечивает выявление уровня липопротеинов и холестерина в крови. Измеряется уровень глюкозы, молочных кислот, электролита, аммиачных веществ и других ферментов. Если есть подозрения на токсичную энцефалопатию, выполняются тесты на алкоголь, наркотические и яды в организме.
Немалое значение в постановке диагноза имеет медицинское оборудование. Ультразвуковое исследование обеспечивает обнаружение структурированных искажений коры головного мозга. Также изучают сосудистые рисунки и проверяют функциональность стенок артерий. УЗИ позволяет узнать максимум об особенностях пациента и нарушениях головного мозга.
Электроэнцефалография выявляет склонности к эпилепсии, остатки травм (в том числе черепно-мозговых), воспалительные процессы, проходимость артерий и другие похожие болезни.
МРТ определяет злокачественные образования, симптомы инсульта и воспалительных процессов. А ангиография показывает точную картину о функциональных нарушениях мозговой коры.
Реоэнцефалография позволяет анализировать тонус, эластичность, объем и направление кровообращения, образование тромбов в сосудах. Метод используют при подозрении на нарушения кровотока, инсульт, заболевание сосудов головного мозга и так далее.
Для безошибочной постановки диагноза понадобится посетить далеко не единственного доктора, вовремя сдавать все необходимые анализы, а также лично проявить настойчивость и направлять медспециалистов, которым проще прописать симптоматическую поддержку. Лишь так возможно определить наличие или отсутствие патологий, влияющих на течение синдрома энцефалопатии.