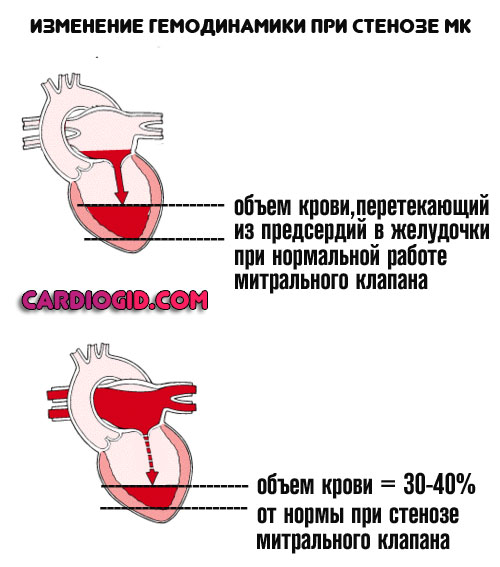
Проводящая система сердца
Содержание:
- Причины СССУ
- Типы заболевания
- Органические аритмии
- Подтверждение синдрома слабости синусового узла
- Гистология
- Влияние сердечной недостаточности
- Биоэлектрические основы ЭКГ
- Патофизиология
- Лечение
- Функция
- ЭХО-кардиографию (ЭХО-КГ)
- Блокада правой ножки пучка Гиса — Нарушения ритма и проводимости сердца
- Патология
- Синусно-предсердный узел —
- Клиническое значение
Причины СССУ
Первичная дисфункция:
- Замещение клеток соединительной тканью — кардиосклероз (постинфарктный, постмиокардитический, кардиомиопатический).
- Врожденное недоразвитие синусового узла.
- Старческий амилоидоз.
- Идиопатическое повреждение, в том числе болезнь Ленегра.
Вторичная дисфункция:
- Повышение тонуса вагуса (блуждающего нерва): синдром каротидного синуса, апноэ сна, вазовагальный обморок, увеличение внутричерепного давления, инфаркт миокарда нижней топики, субарахноидальное кровоизлияние, рефлекс Бецольда–Яриша, болезни гортани и пищевода, кардиоверсия.
- Воздействие лекарств: бетаадреноблокаторы, недигидропиридиновые блокаторы кальциевых каналов, сердечные гликозиды, антиаритмики, холиномиметики, морфин, тиопентал натрия, препараты лития.
- Воспаление сердечной мышцы (миокардит).
- Ишемизация синусового узла.
- Острое повреждение СУ при инфаркте правого предсердия
- Травматическое повреждение клеток синусового узла, проводящей системы (операция, ранение).
- Электролитные нарушения.
- Нарушения газового состава крови (гипоксемия, гиперкапния).
- Дисфункция гормональных систем (чаще всего гипотиреоз).
Типы заболевания
Брадикардия подразделяется на физиологическую (функциональную) и патологическую. Патологическая форма заболевания может быть острой и хронической. В зависимости от причины заболевания брадикардия делится на четыре группы:
- нейрогенная;
- органическая;
- лекарственная
- токсическая
При отсутствии причин, которые могли бы привести к замедлению сердечного ритма, специалисты говорят об идиопатической брадикардии, то есть патологии неизвестного генеза. Как правило, она выявляется у людей зрелого возраста. Это позволяет предположить связь заболевания с процессами, которыми сопровождается старение организма.
Органические аритмии
К органическим аритмиям относятся:
- Аритмии, возникающие при ишемической болезни сердца (инфаркте миокарда, стенокардии). В основе возникновения аритмии лежит повреждение сердечной мышцы. Оно затрудняет правильное распространение электрических импульсов по проводящей системе сердца. Иногда повреждение может затрагивать даже клетки основного водителя ритма — синусового узла. На месте погибших клеток формируется рубец из соединительной ткани (кардиосклероз), которая не способна выполнять функции здорового миокарда. Это, в свою очередь, приводит к формированию аритмогенных очагов и появлению нарушений ритма и проводимости.
- Нарушения ритма, возникающие после воспалительного процесса в сердечной мышце — миокардита. Как следствие после перенесения воспаления также происходит замещение миокарда соединительной тканью (кардиосклероз).
- Аритмии, наблюдающиеся при кардиомиопатиях. По невыясненной пока причине клетки миокарда повреждаются, нарушается насосная функция сердца, развивается сердечная недостаточность. Кроме того, очень часто присоединяются различные нарушения ритма.
- Аритмии, появляющиеся при различных пороках сердца (врождённых и приобретенных в течение жизни). Необходимо отметить, что бывают врожденные первичные заболевания самой проводящей системы сердца.
Подтверждение синдрома слабости синусового узла
Для постановки диагноза необходимо:
- Документировать, то есть доказать, что имеющиеся жалобы связаны с изменениями в сердце (медленным сокращением сердца, паузами в работе сердца, чередованиями медленного и быстрого сокращения сердца). Ведь, как уже говорилось, перечисленные признаки могут наблюдаться и при других заболеваниях.
- Отделить собственно синдром слабости синусового узла от других нарушений регуляции работы сердца.
Решить эти задачи не просто. Иногда приходится прибегать к многократным исследованиям. О них подробнее рассказано в разделе, посвященном диагностике аритмий. Далее мы коснемся только вопросов, относящихся к обсуждаемой теме.
Гистология
В состав образований П. с. с., помимо специализированных кардиомиоцитов, входят нервные элементы (нервные стволы различной толщины, состоящие из миелиновых и безмиелиновых нервных волокон, нервные окончания), соединительная ткань с сосудами. В отличие от сократительного миокарда для П. с. с. характерно количественное преобладание соединительнотканных и нервных элементов над мышечными и сосудистыми. По данным Труэкса (R. Truex) с соавт. (1974), кардиомиоциты П. с. с. при общепринятых гистол. окрасках выглядят светлее, чем клетки сократительного миокарда и отличаются от них по размерам. С помощью электронно-микроскопических исследований установлено, что в этих клетках хорошо развиты комплекс Гольджи (см. Гольджи комплекс), локализующийся около ядра или субсарколеммально, зернистая и незернистая эндоплазматическая сеть (см. Эндоплазматический ретикулум), рибосомы (см.); имеются мелкие округлые митохондрии (см.), небольшое количество лизосом (см.), содержатся гранулы гликогена. Характерной особенностью специализированных кардиомиоцитов является наличие туннелевидных инвагинаций сарколеммы, содержащих соединительнотканные и нервные элементы, выраженных субсарколеммальных цистерн, комплекса миофиламентов с полирибосомами. В зависимости от размера, формы клеток, количества и положения миофибрилл выделяют четыре типа специализированных кардиомиоцитов. Клетки I, II, III типов обнаружены в составе П. с. с. практически у всех млекопитающих, в т. ч. и у человека. Они имеют меньший размер, чем клетки сократительного миокарда. К клеткам I типа относят кардиомиоциты веретеновидной формы, которые по сравнению с кардиомиоцитами сократительного миокарда содержат меньшее количество неправильно ориентированных миофибрилл. Кардиомиоциты II типа имеют неправильную отростчатую форму, содержат примерно такое же количество миофибрилл, как и клетки сократительного миокарда, но в отличие от последнего миофибриллы в кардиомиоцитах II типа расположены беспорядочно.
К кардиомиоцитам III типа относят клетки веретеновидной формы с малым количеством упорядоченно расположенных вдоль длинной оси клетки миофибрилл и большим количеством гранул гликогена. Клетки IV типа (клетки Пуркинье) встречаются лишь у некоторых видов животных. У большинства млекопитающих и человека имеются клетки, подобные клеткам Пуркинье, которые сходны с клетками Пуркинье по функциональным показателям.
Разные части П. с. с. содержат различные типы специализированных кардиомиоцитов. Синусно-предсердный узел состоит из клеток I и II типов, атриовентрикулярный узел — из клеток II и III типов, пучок Гиса содержит клетки всех типов, ножки этого пучка и его концевые разветвления состоят из клеток III типа и клеток, подобных клеткам Пуркинье, или только из последних.
Различают несколько видов контактов между кардиомиоцитами П. с. с. С помощью вставочных дисков и нексусов контактируют между собой гл. обр. клетки II типа, а также клетки III типа. Между клетками I типа эти контакты редки, для них характерны простые контакты. Простые контакты встречаются также и между всеми другими типами кардиомиоцитов П. с. с.
Влияние сердечной недостаточности
Сердечная недостаточность может оказывать следующие влияния на сердце:
- Сердечная мышца может ослабнуть и растянуться. Ослабленная мышца не может сокращаться с должной силой, что приводит к снижению кровотока в организме. Если мышца продолжает ослабевать и растягиваться, то камеры сердца могут увеличиться в размерах. В результате увеличивается давление внутри сердца и может возникнуть обратный ток крови в легкие, приводя к затруднению дыхания.
- СН также может стать причиной увеличения сердечной мышцы и нарушения ее сократимости. При увеличении сердечной мышцы уменьшаются размеры камер, снижается фракция выброса (количество крови, выбрасываемое сердцем за одно сокращение). Гипертрофия или сниженная сократимость сердечной мышцы также могут препятствовать расслаблению сердца и необходимому растяжению мышечных волокон между сокращениями, в результате чего в дальнейшем снижается объем кровотока по телу.
- В результате перечисленных изменений может нарушиться проведение импульсов от синусового узла. В результате этого желудочки могут сокращаться в разное время, что приведет к увеличению объема крови в сердце, преимущественно в левом желудочке.
- Проблемы с проведением импульсов также могут привести к нарушению ритма сердца. Оно может сокращаться медленнее, в результате чего снизится объем кровотока. Сердце также может сокращаться быстрее и/или нерегулярно. У некоторых людей с СН наблюдается комбинированное нарушение ритма сердца. Нарушение ритма может привести к увеличению нагрузки на уже ослабленное сердце.
Когда сердце не способно обеспечить нормальный кровоток, то нарушается кровоснабжение мышц, мозга и других жизненно важных органов. Кровь и другие жидкости могут застаиваться в стопах, ногах, почках и легких.
Биоэлектрические основы ЭКГ
Мышечное волокно – это волокно, которое в состоянии покоя снаружи заряжено положительно, а внутренняя поверхность – отрицательно (это ионы Na, K, Cl, Mg и т.д.). Если к мышечному волокну приложить токорегистрирующий прибор (гальванометр), который может регистрировать разность потенциалов, то стрелка на приборе будет в одном положении.

Рис. 2. Мышечное волокно. Внутренняя поверхность заряжена отрицательно. Наружняя поверхность заряжена положительно.
При возбуждении (процесс деполяризации или окисления) происходит перезарядка мембраны, и мышечное волокно превращается в диполь. Так как перезарядка идет постепенно, сначала количество электричества возрастает, потом уменьшается, если этот процесс растянуть – получается зубец. Отведения регистрируют разность потенциалов между двумя точками.

Рис. 3. Мышечное волокно. Перезарядка мембраны при деполяризации.
Далее происходит процесс восстановления – реполяризация, или восстановление запасов. Происходит поляризация мембраны.
Если произошли изменения в комплексе QRS, сегменте ST, то значит произошел сбой в процессе деполяризации (процессе окисления), т.е. клетка не может нормально работать.
Зубец Т отвечает за восстановление или процесс реполяризации. Таким образом если какие-либо проблемы случаются с зубцом Т, это свидетельствует о нарушении процесса реполяризации (восстановления).
Учитывая то, что все мышечные волокна тесно переплетены друг с другом, и каждое мышечное волокно представляет из себя диполь, а запись идет суммарная, то ЭКГ – это алгебраическая сумма всех потенциалов, которые есть в миокарде. И чем ближе тот или иной полюс подходит к отведению, тем больше зубцы будут получаться. Количество зарядов одинаковое, но перераспределение их разное. Перераспределение зарядов зависит от конфигурации мышечных волокон, от наличия или отсутствия гипертрофии и других процессов, которые могут поражать миокард как диффузно, так и очагово. Это и отражается на электрокардиограмме.
Если представить все сердце как диполь, то окажется, что основание сердца заряжено отрицательно, а верхушка – положительно. Поэтому электрический ток или вектор электродвижущей силы направлен от отрицательной движущей силы к положительной, сверху вниз.
Метки: АВ-соединение, анатомия, биоэлектрические основы ЭКГ, проводящая система сердца, пучок Гиса, СА-узел, сердечно-сосудистые заболевания, сердце, Синусовый узел, ЭКГ
Патофизиология
Брадикардия развивается из-за дисфункции синусового узла. По разным причинам он перестает вырабатывать электроимпульсы с физиологической частотой. При сердечных блокадах происходит неправильное распространение сигналов по проводящим путям. В данном случае нарушается проведение импульсов между синусовым узлом и предсердиями или предсердиями и желудочками.
При умеренной брадикардии пациент не испытывает серьезного ухудшения самочувствия. По мере замедления частоты сердечных сокращений нарастают негативные симптомы. Они связаны с расстройством кровообращения. Кровь переносит питательные вещества и кислород, необходимые для нормальной работы органов и тканей. Из-за брадикардии этот процесс нарушается. У пациента развивается кислородное голодание, которое проявляется слабостью, другими признаками ухудшения самочувствия.
При частоте пульса менее 40 ударов врач определяет выраженную брадикардию. Она приводит к тяжелому нарушению гемодинамики. Медикаментозного лечения может оказаться недостаточно, и пациенту потребуется хирургическое вмешательство по установке кардиостимулятора.
Лечение
Для устранения брадикардии необходимо воздействовать на ее причину. Если заболевание вызвано эндокринной патологией или нарушением баланса электролитов, терапия направлена на коррекцию данных состояний, что приводит к нормализации сердечного ритма.
Если болезнь связана с передозировкой лекарств, их отменяют или корректируют дозы. При брадикардии на фоне интоксикации также требуется воздействовать на основное заболевание.
Если снижение частоты пульса связано с сердечной патологией, врач подбирает лечение в зависимости от клинического случая и выраженности симптомов. Люди с бессимптомным течением заболевания должны наблюдаться у кардиолога, регулярно проходить обследование. Это позволит своевременно обнаружить прогрессирование болезни и приступить к активному лечению.
При выраженной брадикардии показано курсовое лечение препаратами. В их числе:
- кардиопротекторы;
- стимуляторы энергетического обмена в тканях миокарда;
- антиоксиданты;
- препараты с анаболическим эффектом.
Курс приема при поддерживающем лечении составляет от трех до шести месяцев. Комбинация лекарств, их дозировка подбирается врачом, который контролирует ход терапии. Пациентам может быть рекомендован прием растительных препаратов с тонизирующим эффектом. К ним относят средства на основе женьшеня и элеутерококка, красавки.
При тяжелых состояниях, которые сопровождаются выраженной сердечной недостаточностью, пациенту требуется срочная помощь. Для нормализации сердечного ритма используют холинолитики для парентерального введения, адреномиметики, которые стимулируют работу миокарда.
Функция
Кардиостимуляция
Основная роль клетки синоатриального узла заключается в инициировании потенциалов действия сердца, которые могут проходить через клетки сердечной мышцы и вызывать сокращение. Потенциал действия — это быстрое изменение мембранного потенциала , вызванное движением заряженных атомов ( ионов ). В отсутствие стимуляции клетки, не являющиеся водителями ритма (включая клетки желудочков и предсердий ), обладают относительно постоянным мембранным потенциалом; это известно как потенциал покоя . Эта фаза покоя (см. Потенциал действия сердца, фаза 4 ) заканчивается, когда потенциал действия достигает клетки. Это приводит к положительному изменению мембранного потенциала, известному как деполяризация , который распространяется по всему сердцу и вызывает сокращение мышц . Однако у кардиостимуляторов нет потенциала покоя. Вместо этого сразу после реполяризации мембранный потенциал этих клеток снова начинает автоматически деполяризоваться — явление, известное как потенциал пейсмекера . Как только потенциал кардиостимулятора достигает установленного значения, порогового потенциала , он создает потенциал действия. Другие клетки сердца (включая волокна Пуркинье и атриовентрикулярный узел ) также могут инициировать потенциалы действия; однако они делают это медленнее, и поэтому, если узел SA функционирует должным образом, его потенциалы действия обычно перекрывают те, которые были бы произведены другими тканями.
Ниже описаны 3 фазы потенциала действия синоатриального узла. В потенциале действия сердца есть 5 фаз (обозначены 0-4), однако потенциалы действия кардиостимулятора не имеют очевидной фазы 1 или 2.
Этап 4
Рисунок 3: Форма волны потенциала действия синоатриального узла, показывающая основные задействованные ионные токи (отклонение вниз указывает на движение ионов в клетку, отклонение вверх указывает на ионы, вытекающие из клетки).
Эта фаза также известна как потенциал кардиостимулятора . Сразу после реполяризации, когда мембранный потенциал очень отрицательный (он гиперполяризован), напряжение начинает медленно расти. Первоначально это происходит из-за закрытия калиевых каналов , что снижает поток ионов калия (I k ) из клетки (см. Фазу 2 ниже). Гиперполяризация также вызывает активацию активируемых гиперполяризацией циклических нуклеотидно-управляемых каналов (HCN) . Активация ионных каналов при очень отрицательных мембранных потенциалах необычна, поэтому поток натрия (Na + ) и некоторого количества K + через активированный канал HCN упоминается как забавный ток (I f ). Этот забавный ток заставляет мембранный потенциал клетки постепенно увеличиваться, поскольку положительный заряд (Na + и K + ) течет в клетку. Другой механизм, влияющий на потенциал водителя ритма, известен как кальциевые часы. Это относится к спонтанному высвобождению кальция из саркоплазматического ретикулума (хранилища кальция) в цитоплазму, также известного как кальциевые искры . Это увеличение кальция в клетке затем активирует натрий-кальциевый обменник (NCX), который удаляет один Ca 2+ из клетки и обменивает его на 3 Na + в клетке (таким образом снимая заряд +2 с клетки, но позволяя заряду +3 проникнуть в клетку), дополнительно увеличивая мембранный потенциал. Позже кальций повторно поступает в клетку через SERCA и кальциевые каналы, расположенные на клеточной мембране. Увеличение мембранного потенциала, вызванное этими механизмами, активирует кальциевые каналы Т-типа, а затем кальциевые каналы L-типа (которые открываются очень медленно). Эти каналы обеспечивают поток Ca 2+ в клетку, делая мембранный потенциал еще более положительным.
Фаза 0
Это фаза деполяризации. Когда мембранный потенциал достигает порогового значения (от -20 до -50 мВ), клетка начинает быстро деполяризоваться (становиться более положительной). Это в основном связано с потоком Ca 2+ через кальциевые каналы L-типа, которые теперь полностью открыты. На этом этапе отключаются кальциевые каналы Т-типа и каналы HCN.
Фаза 3
Эта фаза — фаза реполяризации. Это происходит из-за инактивации кальциевых каналов L-типа (предотвращение движения Ca 2+ в клетку) и активации калиевых каналов, что позволяет выходить из клетки K + , делая мембранный потенциал более отрицательным.
ЭХО-кардиографию (ЭХО-КГ)
При выявлении у пациента в ходе осмотра повышенных цифр артериального давления, расширения границ сердца, шумов при выслушивании сердца, выявлении на ЭКГ патологических изменений, а также, если на рентгенограмме органов грудной клетки видны изменения размера и формы сердца, нетипичное его расположение, или же определяются видоизмененные аорта и легочная артерия, врач назначает ультразвуковое исследование сердца: трансторакальную ЭХО-кардиографию.
ЭХО-кардиография (ЭХО-КГ, УЗИ сердца) это ультразвуковой метод исследования строения и функции сердца. Метод основан на улавливании датчиком отраженных от структур сердца ультразвуковых сигналов и преобразовании их в изображение на экране монитора. При выполнении ЭХО-КГ врач оценивает:
- размеры сердца и его камер, а также давление в них,
- состояние предсердий и желудочков (камер сердца) и клапанов сердца,
- толщину стенок сердца, их структуру и целостность,
- сократительную функцию миокарда (работу сердечной мышцы),
- особенности движения крови внутри сердца через клапаны
- состояние внешней оболочки сердца – перикарда
- состояние легочной артерии и аорты, давление в них.
ЭХО-КГ является основным методом диагностики острых и хронических заболеваний сердца: пороков, воспалительных заболеваний клапанного аппарата сердца и его оболочек (эндокардит, перикардит). При данном исследовании также проводится оценка и уточняется степень гипертрофии миокарда, наличие дисфункции работы сердечной мышцы при ее поражении (инфаркт, миокардит), наличие тромбов в полостях сердца. Врач-кардиолог или терапевт, соотнося данные, полученные при ЭХО-КГ с клинической картиной, решают вопрос о тактике дальнейшего ведения пациента.
Блокада правой ножки пучка Гиса — Нарушения ритма и проводимости сердца
10.4. Нарушения внутрижелудочковой проводимости
10.4.1. Блокада правой ножки пучка Гиса (БПНПГ)
Блокада правой ножки пучка Гиса (БПНПГ) у молодых людей встречается в 0,1—0,2% случаев. С возрастом ее частота возрастает, достигая у людей старше 40 лет 0,3—0,24—4,5%. БПНПГ чаще возникает у мужчин.
При остром инфаркте миокарда БПНПГ появляется в 2—3,7% случаев и в основном при переднем инфаркте, чаще при трансмуральном. Частичная БПНПГ встречается и при заднем инфаркте миокарда.
Этиология. У молодых людей блокада правой ножки пучка Гиса часто (21— 50% случаев) доброкачественная, не связана с сердечной патологией. В остальных случаях, особенно у пожилых людей,
БПНПГ обусловлена гипертонической болезнью (60% случаев), ИБС (хотя она чаще вызывает блокаду левой ножки пучка Гиса). Реже причиной БПНПГ могут быть врожденная аномалия — недоразвитие начального сегмента правой ножки пучка Гиса; врожденные пороки сердца (дефект межпредсердной, реже межжелудочковой перегородки, стеноз устья легочной артерии); растяжение правого желудочка при тромбоэмболии легочной артерии или при обструктивных хронических заболеваниях легких (тогда чаще возникает частичная блокада правой ножки пучка Гиса); болезни Lev и Lenegre; острый инфаркт миокарда; кардиомиопатии; тупая травма грудной клетки; гиперкалиемия, прогрессирующая мышечная дистрофия; передозировка новокаинамида, хинидина, реже сердечных гликозидов; новообразования сердца; хирургические операции на сердце, например вертикальная вентрикулотомия; сифилитическая гумма.
Клиническая картина.
Могут выявляться клинические признаки органического заболевания, вызвавшего БПНПГ. Кроме того, у 1/з больных определяются некоторые изменения при аускультации: расщепление II тона, встречаемое чаще, и расщепление I тона, встречаемое реже (из-за асинхронного сокращения желудочков).
Диагностические ЭКГ-критерии. Полная БПНПГ: продолжительность комплекса #Я5>0,12 с; высокий зубец R или R’ в отведении Vi, иногда и в V2, з (перед зубцом R обычно регистрируется маленький п. В aVR отведении часто бывает глубокий зубец Q и широкий, зазубренный зубец R. В I и левых грудных отведениях обычно выявляется различной величины зубец R и широкий, зазубренный зубец S); ST и Т отклонены дискордантно от основного направления комплекса QRS. При отклонении электрической оси влево в отведении Vj регистрируются формы rR зазубренный R или qR. При отклонении электрической оси вправо в отведении V1 наблюдается форма qR.
Частичная БПНПГ: морфология комплекса QRS идентична полной БПНПГ, однако продолжительность его 0,11 с. При увеличении степени блокады продолжительность комплекса QRS увеличивается и R’ дефлексия в отведении Vi становится более высокой. Чаще (в 87% случаев) БПНПГ бывает постоянной, реже— интермиттирующей.
Лечение.
блокада правой ножки пучка Гиса в специальном лечении не нуждается. Появление БПНПГ в остром периоде инфаркта миокарда профилактической эпдокардиальной стимуляции не
требует. Если необходимо, проводят лечение основного заболевания, вызвавшего БПНПГ.
Прогноз: у молодых людей без органического заболевания сердца относительно благоприятный. Большинство авторов считают, что изолированная БПНПГ никогда не переходит в полную АВ блокаду и даже совместная находка атриовентрикулярной блокады I степени не имеет прогностического значения, так как при ЭФИ в таких случаях, как правило, находят лишь удлинение интервала А—Н, указывающее на ухудшение АВ проводимости в АВ соединении. Однако некоторые авторы указывают на редкое (1,8—6%) прогрессирование БПНПГ в АВ блокаду II или III степени.
Присоединившаяся БПНПГ на фоне гипертопической болезни или ИБС ухудшает прогноз, увеличивая летальность почти в 3 раза. Прогноз ухудшают кардиомегалия, сердечная недостаточность, удлинение интервала Н—V. Прогноз при БПНПГ всегда лучше, чем при блокаде левой ножки пучка Гиса.
На фоне острого инфаркта миокарда появившаяся полная или частичная БПИПГ не переходит, по нашим данным , в полную АВ блокаду и не ухудшает исход заболевания. Некоторые авторы при БПНПГ отмечают увеличение летальности, но только при обширном трансмуральном инфаркте миокарда с сердечной недостаточностью. На отдаленный прогноз инфаркта БПНПГ не влияет, хотя есть и противоположное мнение.
Патология
Пороки развития П. с. с. могут возникать вследствие нарушения формирования межжелудочковой перегородки, при этом двойной контакт бульбовентрикулярного и атриовентрикулярного колец может привести к образованию двух (переднего и заднего) раздельных атриовентрикулярных узлов. Аномальные связи между другими специализированными мышечными кольцами приводят к возникновению ряда дополнительных проводящих структур, описанных в 1976 г. Венинком у некоторых животных и человека: ретроаортального узла, узлоподобных структур в межпредсердной перегородке, проводящих элементов атриовентрикулярного кольца. Исследования Андерсона (R. Н. Anderson) с соавт. (1977) показали, что нарушение нормальной связи предсердного и желудочкового миокарда при отделении атриовентрикулярного узла от одноименного пучка может привести к врожденной полной блокаде сердца, а наличие дополнительных проводящих путей (пучок Кента) между предсердиями и желудочками, идущих в обход атриовентрикулярного пучка, может способствовать развитию синдрома Вольффа — Паркинсона — Уайта (см. Вольффа-Паркинсона-Уайта синдром). При наличии пучка Джеймса, соединяющего миокард предсердия со стволом атриовентрикулярного пучка, или волокон Махейма, соединяющих ствол атриовентрикулярного пучка с миокардом желудочков, могут развиваться различные формы синдрома преждевременного возбуждения желудочков.
Приобретенная патология П. с. с. может возникать при функциональных или органических ее повреждениях (воспалении, ишемии, некрозе, дистрофии). В зависимости от уровня, степени и характера поражения П. с. с. развиваются различного типа нарушения нормальной координации сокращений между различными участками миокарда или отделами сердца (см. Аритмии сердца, Блокада сердца, Мерцательная аритмия, Пароксизмальная тахикардия, Сердце, патология, Экстрасистолия),
Библиография: Братанов В. С. Индивидуальные и возрастные особенности топографии предсердно-желудочковой проводящей системы человека, Вестн. хир., т. 105, № 10, с. 22, 1970; Михайлов С. С. и Ч укбар А. В. Топография элементов проводящей системы сердца человека, Арх. анат., гистол, и эмбриол., т. 44, № 6, с. 56, 1982; У м о-в и с т В. Н. Проводящая система при врожденных дефектах перегородок сердца, Киев, 1973, библиогр.; X у б у-тия Б. И., Ермолова 3. С. и Телятников С. С. Хирургическая анатомия проводящей системы сердца, Грудн. хир., № 1, с. 41, 1975; Ч е р в о-в а И. А. и Павлович Е. Р. Морфология основных отделов проводящей системы сердца крысы, Арх. анат., гистол, и эмбриол., т. 77, № 8, с. 67, 1979; А п-d er son R. Н. а. о. Congenitally complete heart block, developmental aspects, Circulation, v. 56, p. 90, 1977; В 1 о о г С. М. Cardiac pathology, Philadelphia, 1978; Brechenmacher C. Atrio-His bundle tracts, Brit. Heart J.* v. 37, p. 853, 1975; В u г с h e 1 1 H. B. In support of Kent, J. thorac. cardiovasc. Surg., v. 79, p. 637, 1980; The conduction system of the heart, Structure, function and clinical implications, ed. by H. J. Wel-lens a. o., p. 55, Leiden, 1976; D a-v i e s M. J. Pathology of conducting tissue of the heart, L., 1971; E 1 i s k a O. a. E 1 i s k о у a M. Venous circulation of the human cardiac conduction system, Brit. Heart J., v. 42, p. 508, 1979; они ж e, Lymphatic drainage of the ventricular conduction system in man and in the dog, Acta anat., v. 107, p. 205, 1980; Gardner E. a. O’ R a h i 1 1 у R. The nerve supply and conducting system of the human heart at the end of the embryonic period proper, J. Anat., v. 121, p. 571, 1976; Michailow S. Neue anatomische Forschungsergebnisse vom Nerven- und Reizleitungssystem des Herzens, S. 84, Stuttgart, 1974; Navaratnam V. The human heart and circulation, L.— N. Y., 1975; Osterwalder B. a. Schneider J. Morphologische Untersuchungen am menschlichen Reizleitungs, в кн.: Probleme der Medizin in der Ud SSR, hrsg. v. V. Parin u. L. Staroselsij, system, Schweiz, med. Wschr., S. 953, 1976; Sherf L. a. James Th. N. Fine structure of cells and their histologic organization within internodal pathways of the heart, clinical and electrocardiographic implications, Amer. J. Cardiol., v. 44, p. 345, 1979; Van der Hauwaert L. G., Stroobandt R. a. Yerhaeghe L. Arterial blood supply of the atrioventricular node and main bundle, Brit. Heart J., v. 34, p. 1045, 1972; Wenink A. C. G. Development of the human cardiac conducting system, J. Anat., v. 121, p. 617, 1976.
Синусно-предсердный узел —
Синусно-предсердный узел, nodus sinuatrialis, расположен в участке стенки правого предсердия, соответствующем sinus venosus холоднокровных (в sulcus terminalis, между верхней полой веной и правым ушком). Он связан с мускулатурой предсердий и имеет значение для их ритмичного сокращения.
Какие анализы и диагностики нужно проходить для Синусно-предсердного узла:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Синусно-предсердном узле или же Вам необходим осмотр? Вы можете записаться на прием к доктору – клиника Eurolab всегда к Вашим услугам! Лучшие врачи осмотрят Вас, проконсультируют, окажут необходимую помощь и поставят диагноз. Вы также можете вызвать врача на дом. Клиника Eurolab открыта для Вас круглосуточно.
Как обратиться в клинику:
Телефон нашей клиники в Киеве: (+38 044) 206-20-00 (многоканальный). Секретарь клиники подберет Вам удобный день и час визита к врачу. Наши координаты и схема проезда указаны здесь. Посмотрите детальнее о всех услугах клиники на ее персональной странице.
| (+38 044) 206-20-00 |
Если Вами ранее были выполнены какие-либо исследования, обязательно возьмите их результаты на консультацию к врачу.
Если исследования выполнены не были, мы сделаем все необходимое в нашей клинике или у наших коллег в других клиниках.
Необходимо очень тщательно подходить к состоянию Вашего здоровья в целом. Есть много болезней, которые по началу никак не проявляют себя в нашем организме, но в итоге оказывается, что, к сожалению, их уже лечить слишком поздно. Для этого просто необходимо по несколько раз в год проходить обследование у врача, чтобы не только предотвратить страшную болезнь, но и поддерживать здоровый дух в теле и организме в целом.
Если Вы хотите задать вопрос врачу – воспользуйтесь разделом онлайн консультации, возможно Вы найдете там ответы на свои вопросы и прочитаете советы по уходу за собой. Если Вас интересуют отзывы о клиниках и врачах – попробуйте найти нужную Вам информацию на форуме. Также зарегистрируйтесь на медицинском портале Eurolab, чтобы быть постоянно в курсе последних новостей и обновлений информации о Синусно-предсердном узле на сайте, которые будут автоматически высылаться Вам на почту.
Другие анатомические термины на букву «С»:
| Сперматозоид |
| Семенные пузырьки |
| Стопа |
| Селезенка |
| Сердце |
| Средний мозг |
| Скелетные мышцы |
| Средостение |
| Спинной мозг |
| Среднее ухо |
| Слюнные железы |
| Слюна |
| Сердечно-сосудистая система |
| Сустав |
| Скелет |
| Соматическая (произвольная) нервная система |
| Симпатическая нервная система |
| Синапс |
| Сетчатка глаза |
| Слезная железа |
| Слуховой нерв |
| Слизистая оболочка |
| Сальные железы |
| Семявыводящий проток |
| Сперма |
| Средний палец |
| Семенной канатик |
| Соматическая нервная система |
| Спинномозговая жидкость |
| Сосуды головного мозга |
| Спинномозговые нервы |
| Срединный нерв |
| Седалищный нерв |
| Слуховая, или евстахиева, труба |
| Слуховой анализатор |
| Склера |
| Сосудистая оболочка глаза |
| Синдесмоз |
| Синхондроз |
| Связки |
| Слезная кость |
| Сошник |
| Скуловая кость |
| Среднезапястный сустав |
| Седалищная кость |
| Суставы таза |
| Скелет свободной нижней конечности |
| Суставы костей голени |
| Суставы стопы |
| Средние мышцы шеи |
| Серозная оболочка |
| Слепая кишка |
| Сигмовидная ободочная кишка |
Клиническое значение
Дисфункция синусового узла описывает нерегулярное сердцебиение, вызванное ошибочными электрическими сигналами сердца. Когда синоатриальный узел сердца неисправен, сердечные ритмы становятся ненормальными — обычно слишком медленными или с паузами в своей функции или комбинации, и очень редко быстрее, чем обычно.
Таким образом, блокировка артериального кровоснабжения узла SA (чаще всего из-за инфаркта миокарда или прогрессирующей ишемической болезни сердца ) может вызвать ишемию и гибель клеток в узле SA. Это может нарушить функцию электрического водителя ритма в узле SA и привести к синдрому слабости синусового узла .
Если узел SA не функционирует или импульс, генерируемый в узле SA, блокируется до того, как он перемещается по системе электропроводности, группа клеток, расположенных дальше по сердцу, станет его кардиостимулятором.