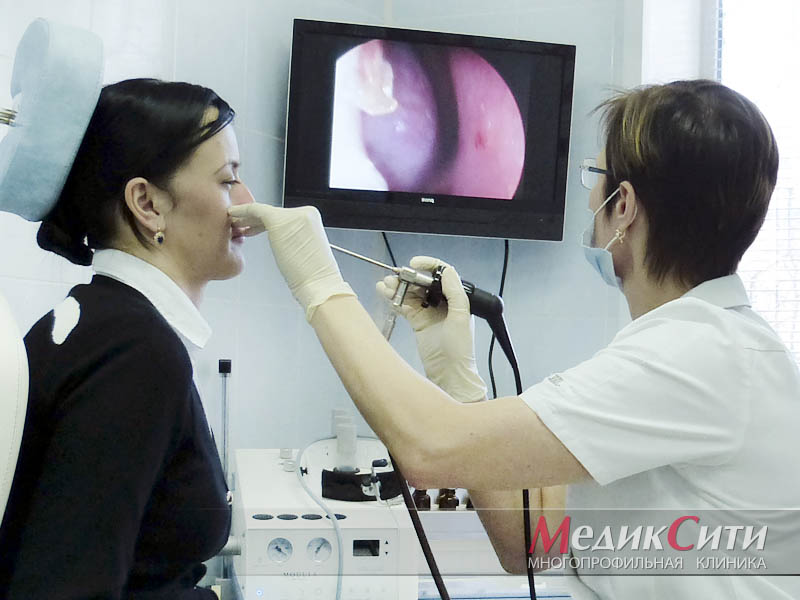
Дефект межжелудочковой перегородки
Содержание:
- Диагностика
- Лечение дефекта
- Причины возникновения ДМЖП у ребенка
- Виды дефектов межжелудочковой перегородки у новорожденных
- Как заподозрить порок: симптомы и признаки у ребенка
- Причины и разновидности
- 9.9. СТЕНОЗ ЛЁГОЧНОЙ АРТЕРИИ
- Аномалии положения сердца плода
- Врождённые дефекты сердца
- Причины ВПС
- Часто задаваемые вопросы
- Правое предсердие
- Классификация дефектов межжелудочковой перегородки
- Лечение дефекта межпредсердной перегородки
- Что это такое
- Левое предсердие
- Случай из практики
Диагностика
РентгенографияПри ДМЖП у новорожденных выявляют:
- увеличение границ сердца, особенно правой его стороны;
- увеличение легочной артерии, которая несет кровь от сердца к легким;
- переполнение и спазм сосудов легких;
- жидкость в легких или отек легких, проявляется затемнением на снимке.
ЭлектрокардиографияУЗИ сердца допплеровское исследование
- отверстие в перегородке между желудочками;
- его размер и расположение;
- красным цветом отражается поток крови, который движется в сторону датчика, а синим – кровь которая течет в противоположном направлении. Чем светлее оттенок, тем выше скорость движения крови и давление в желудочках.
Данные инструментального обследования у новорожденных
Рентгенологическое исследование грудной клетки
- В первой стадии:
- увеличенные размеры сердца, оно округлое, без сужения посередине;
- сосуды легких выглядят нечетко и размыто;
- могут появиться признаки отека легких – затемнение по всей поверхности.
- В переходной стадии:
- сердце имеет нормальные размеры;
- сосуды выглядят нормально.
- Третья стадия склеротическая:
- сердце увеличено, особенно с правой стороны;
- увеличена легочная артерия;
- видны только крупные сосуды легких, а мелкие незаметны из-за спазма;
- ребра расположены горизонтально;
- диафрагма опущена.
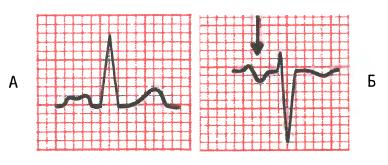
Электрокардиография
- Первая стадия может не проявляться никакими изменениями или же появляется:
- перегрузка правого желудочка;
- увеличение правого желудочка.
- Вторая и третья стадия:
- перегрузка и увеличение левого предсердия и желудочка.
- нарушения прохождения биотоков по ткани сердца.
Двухмерная допплер-эхокардиографияУЗИ сердца
- выявляет место расположения дефекта в перегородке;
- размер дефекта;
- направление тока крови из одного желудочка в другой;
- давление в желудочках первой стадии не больше 30 мм рт. ст., во второй стадии – от 30 до 70 мм рт. ст., а в третьей – более 70 мм рт. ст.
Лечение дефекта
Лечение не требуется в двух случаях: если дефект состоит из мышечной ткани (вне зависимости от размера и локализации от него можно ожидать самостоятельного закрытия), а также, если отверстие небольшое, а ребенку не более двух лет. Маленькие повреждения могут затягиваться в раннем детском возрасте – поэтому требуется только наблюдение.
Остальным пациентам необходима специфическая операция – закрытие дефекта межжелудочковой перегородки. Несмотря на то, что процедуру стараются провести как можно раньше, иногда требуется выждать некоторое время. В таком случае назначают поддерживающую медикаментозную терапию, призванную снизить нагрузку на сердечную мышцу и поддержать сосуды. Существует два принципиально разных подхода к хирургии: эндоваскулярное лечение и открытая операция. Последний вариант сложный технически – требуется специальное оборудование для поддержания искусственного кровообращения, а реабилитационный период может протекать с осложнениями.
Причины возникновения ДМЖП у ребенка
ДМЖП у ребенка — врожденная аномалия, которая формируется внутриутробно. Нередко она развивается параллельно с иными пороками — незакрытый артериальный проток, аортальная недостаточность и пр.
Дефект межжелудочковой перегородки у ребенка может развиваться вследствие таких воздействий на организм матери в период вынашивания:
- гормональный дисбаланс;
- инфекции, вирусные заболевания;
- воздействие радиации;
- употребление алкоголя, курение;
- патологии беременности — угроза выкидыша, токсикозы.
Также ДМЖП у ребенка может возникнуть, если будущая мама перенесла инфаркт миокарда.
Виды дефектов межжелудочковой перегородки у новорожденных
Дефект межжелудочковой перегородки у новорожденного склонен иметь разное размещение.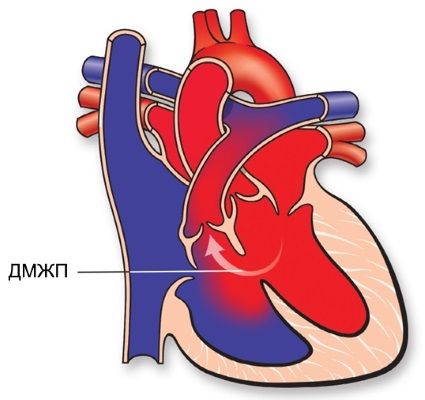
Учитывая этот параметр, выделяют несколько форм болезни:
- Трабекулярный. Для него характерно размещение в любом месте мембраны, окружен мышечными волокнами.
- Перимембранозный дефект межжелудочковой перегородки у новорожденного. Чаще всего размещен книзу от аортального клапана.
- Субпульмонарный выброс. Дефект межжелудочковой перегородки сердца у новорожденных присутствует около легочной артерии. Нередко сопровождается обратным забросом аортальной крови.
- Впускная аномалия. Локализуется сзади относительно мембранной перепонки и граничит с 3-створчатым клапаном.
Если перимембранозный дефект межжелудочковой перегородки у новорожденного имеет диаметр более 1 см, развиваются осложнения — синдром Эйзенменгера, сердечная недостаточность, легочная гипертензия.
Как заподозрить порок: симптомы и признаки у ребенка
При незначительном размере отверстия ваш малыш ничем не будет отличаться от сверстников. Вероятно, ещё в родильном отделении неонатолог сообщит, что у вашего младенца обнаружен систолический сердечный шум. Родители обычно с тревогой спрашивают при каждой аускультации: «Шум – уменьшился или стал сильнее?» Парадокс ДМЖП в том, что интенсивность шума обратно пропорциональна размерам отверстия. Чем слабее шум – тем больше величина дефекта.
Серьезнее ситуация, если малыш родился «без шума», но:
- с трех-четырехнедельного возраста вдруг перестал набирать вес при достаточном количестве молока у матери;
- у него появилась одышка во время кормления;
- респираторные инфекции «преследуют» его чаще, чем других детей;
- иногда ребенок начинает «синеть»;
- при осмотре врач вдруг обнаруживает расширение границ сердца, увеличение печени.
В дальнейшем клиническая картина характеризуется разлитым усиленным верхушечным толчком, появлением систолического дрожания слева в третьем-четвертом межреберьях, расширением границ сердца, особенно влево, образованием сердечного горба (грудь Девиса).
Причины и разновидности
Патологическое отверстие формируется еще в ходе эмбрионального развития – поэтому заболевание и называется врожденный порок сердца.
Существует ряд факторов, которые могут спровоцировать рождение ребенка с пороком сердца:
- Инфекционные болезни. Особенно опасны для развития ребенка такие болезни, как краснуха, корь и ветрянка. К счастью, сейчас для женщин, которые не смогли переболеть до родов, существует вакцина.
- Курение, употребление алкоголя, прием наркотиков.
- Некоторые лекарственные препараты, например, литийсодержащие, могут спровоцировать развитие порока сердца.
- Наличие генетической предрасположенности: по статистике, один случай из двадцати объясняется наследственностью.
Если дефект небольшой, то симптомы выражены не так явно, как при крупном. Большие множественные отверстия считаются самой тяжелой формой заболевания. Если дефект состоит из мышц, то есть вероятность, что он самостоятельно затянется в течение первого года жизни – это происходит из-за общего развития мышечной стенки сердца. В остальных случаях ожидать самовыздоровления не стоит – поэтому операцию проводят как можно раньше, если это позволяет состояние ребенка.
Показания
- наличие отверстия в перегородке между желудочками сердца;
- патологический заброс крови в правый желудочек;
- повышенная нагрузка на правый желудочек;
- выраженная симптоматика.
Противопоказания
- особое расположение отверстия – близко к клапанам сердца;
- наличие некоторых других заболеваний сердца;
- непоправимые изменения в легких;
- нарушение свертываемости крови;
- острые инфекционные и воспалительные заболевания.
9.9. СТЕНОЗ ЛЁГОЧНОЙ АРТЕРИИ
Стеноз лёгочной артерии — сужение выносящего тракта правого желудочка в области клапана лёгочной артерии.
Распространённость
Изолированный стеноз лёгочной артерии составляет 8-12% всех врождённых пороков сердца. В большинстве случаев это клапанный стеноз (третий наиболее частый врождённый порок сердца), но он может также быть комбинированным (в сочетании с подклапанным, надклапанным стенозами, другими врождёнными пороками сердца).
ГЕМОДИНАМИКА
Сужение может быть клапанным (80-90% случаев), подклапанным, надклапанным.
• При клапанном стенозе клапан лёгочной артерии может быть одностворчатым, двустворчатым и трёхстворчатым. Характерно постстенотическое расширение ствола лёгочной артерии.
• Изолированный подклапанный стеноз характеризуется инфундибулярным (воронкообразным) сужением выносящего тракта правого желудочка и аномальным мышечным пучком, препятствующим выбросу крови из правого желудочка (оба варианта обычно сочетаются с ДМЖП).
• Изолированный надклапанный стеноз может быть в виде локализованного стеноза, полной или неполной мембраны, диффузной гипоплазии, множественных периферических стенозов лёгочной артерии.
При сужении лёгочного ствола возникает увеличение градиента давления между правым желудочком и лёгочной артерией. Из-за препятствия на пути тока крови возникает гипертрофия правого желудочка, а затем его недостаточность. Это приводит к повышению давления в правом предсердии, открытию овального отверстия и сбросу крови справа налево с развитием цианоза и правожелудочковой недостаточности. У 25% больных стеноз лёгочной артерии сочетается со вторичным ДМПП.
Аномалии положения сердца плода
Среди аномалий расположения сердца выделяют эктопию сердца (размещение вне грудной клетки). К таким патологиям относят декстрокардию (смещение сердца в правую сторону относительно нормального положения) и мезокардию (расположение сердца не с левой стороны грудины, а по срединной линии тела).
Эктопия сердца у плода возникает на сроке 14-18 дней с момента зачатия мезадерма начинает развиваться неправильно, что вызывает неправильное срастание брюшной стенки. У плода либо отсутствует диафрагма вообще, либо нет диафрагмального сегмента перикарда.
Из-за отверстия в стенке между правым и левым желудочком слышны интракардиальные шумы. Также у плода эктопия сердца нередко сопровождается другими аномалиями — гидроцефалией, энцефалоцеле и пр.
Надо сказать, что существует высокая вероятность ошибочного диагноза по установки положения сердца. При тазовом предлежании плода на УЗИ сердца визуализируется справа, хотя на самом деле оно располагается в положенном месте.
В 71% случаев эктопия сердца вызывается плевральным выпотом, кистозным аденоматозным пороком развития лёгкого, диафрагмальной грыжей.
Различают четыре вида эктопии:
- абдоминальная (сердце находится в брюшине);
- грудная (сердце выходит наружу через дефекты грудины);
- торакоабдоминальная (пентада Кантрелла – сложнейшая патология, имеющая комплекс отклонений от нормы);
- шейная (сердце смещается в область сердца).
Грудная эктопия встречается в 55-60% случаев, торакоабдоминальная — в 38%, шейная — почти в 3%. Выживаемость составляет около 10%. В большинстве случаев при эктопии младенец либо рождается мёртвым, либо умирает сразу после рождения.
Патология сопровождается смещением других внутренних органов, которые не защищены от механических повреждений и подвержены инфекциям и вирусам больше обычного.
Врождённые дефекты сердца
Пять наиболее встречаемых дефектов — это тетрада Фалло, дефект межжелудочковой перегородки, транспозиция магистральных сосудов, коарктация аорты, гипоплазия левых камер.
Оптимальным сроком для проведения ультразвуковой диагностики сердца плода считается период 24-26 недель беременности. Именно в это время анатомические структуры сердца максимально визуализируются, а на более ранних сроках можно увидеть только явные и глобальные пороки сердца.
Наиболее информативен ультразвуковой осмотр 4-камерного среза сердца. После которого при любом отклонении от нормы женщина отправляется на более детальное обследование плода с использованием допплеровской эхокардиографии. Также проводится кариотипирование, потому что в 30% случаев аномалии являются результатом хромосомных нарушений.
Причины ВПС
В качестве основных ведущих причины в формировании пороков, чаще всего, выступают структурные и количественные хромосомные аномалии, и мутации, т.е. первичные генетические факторы.
Также необходимо уделять внимание потенциально тератогенным факторам внешней среды: различные внутриутробные инфекции (вирусы краснухи, цитомегаловирус, коксаки, инфекционные заболевания у матери в первом триместре), лекарственные препараты (витамин А, противоэпилептические средства, сульфазалазин, триметоприм), постоянный контакт с токсичными веществами (краски, лаки). Кроме того, нужно помнить, что отрицательное влияние на внутриутробное развитие оказывают как материнские факторы: предшествующие данной беременности репродуктивные проблемы, наличие сахарного диабета, фенилкетонурии, алкоголизма, курение, возраст, но также, и факторы со стороны отца – возраст, употребление наркотических средств (кокаин, марихуана).. Ведущая роль принадлежит мультифакториальной теории развития врожденных пороков сердца (до 90%).
Ведущая роль принадлежит мультифакториальной теории развития врожденных пороков сердца (до 90%).
Виды врожденных пороков сердца
-
Дефект межпредсердной перегородки (ДМПП) или открытое овальное окно – диагностируется при выявлении одного либо нескольких отверстий в межпредсердной перегородке. Один из часто встречающихся врожденных пороков сердца. В зависимости от расположения дефекта, его величины, силы тока крови определяются более или менее выраженные клинические признаки. Часто ДМПП сочетается с другими аномалиями сердца и определяться при синдроме Дауна.
-
Дефект межжелудочковой перегородки (ДМЖП) – диагностируется при недоразвитии межжелудочковой перегородки на различных уровнях с формированием патологического сообщения между левым и правым желудочками. Может встречаться как изолированно, так и вместе с другими аномалиями развития. При малом дефекте – чаще нет выраженного отставания в физическом развитии. ДМЖП опасен тем, что может приводить к развитию легочной гипертензии, и потому, должен своевременно корректироваться оперативным путем.
-
Коартация аорты – сегментарное сужение просвета аорты с нарушением нормального кровотока из левого желудочка в большой круг кровообращения. Выявляется до 8% всех случаев ВПС, чаще у мальчиков, нередко сочетается с другими аномалиями.
-
Открытый артериальный проток – диагностируется при не заращении Баталлова протока, определяемого у новорожденных и зарастающего в последующем. В результате, происходит частичный сброс артериальной кровь из аорты в легочную артерию. При данном ВПС чаще не бывает тяжелых клинических проявлений, однако, патология требует хирургической коррекции, поскольку сопряжена с высоким риском внезапной сердечной смерти.
-
Атрезия легочной артерии – диагностируется недоразвитие (полное либо частичное) створок клапана легочной артерии с развитием обратного заброса крови из легочной артерии в полость правого желудочка. В последующем приводит к недостаточному кровоснабжению легких.
-
Стеноз клапана легочной артерии – аномалия, при которой диагностируют сужение отверстия клапана легочной артерии. В результате патологии, чаще всего, створок клапана, нарушается нормальный кровоток из правого желудочка в легочный ствол.
-
Тетрада Фалло – сложный сочетанный ВПС. Объединяет дефект межжелудочковой перегородки, стеноз легочной артерии, гипертрофию правого желудочка, декстрапозицию аорты. При данной патологии происходит смешение артериальной и венозной крови.
-
Транспозиция магистральных сосудов – также сложный ВПС. При данной патологии аорта отходит от правого желудочка и несет венозную кровь, а легочный ствол отходит от левого желудочка и несет артериальную кровь, соответственно. Парок протекает тяжело, сопряжен с высокой летальностью новорожденных.
-
Декстрокардия – аномалия внутриутробного развития, арактеризующаяся правосторонним размещением сердца. Зачастую, наблюдается «зеркальное» расположениее других непарных внутренних органов.
-
Аномалия Эбштейна – редко встречающийся врожденный порок сердца, диагностируется при изменении месторасположения створок трехстворчатого клапана. В норме — от предсердно-желудочкового фиброзного кольца, при аномалии — от стенок правого желудочка. Правый желудочек имеет меньшие размеры, а правое предсердие удлинено, вплоть до аномальных клапанов.
Часто задаваемые вопросы
Каким способом производится обезболивание при операции?
Анестезия может быть как местной, так и общей. Выбор зависит от решения врачей, которые будут проводить эту операцию. Если пациент хорошо переносит общий наркоз, то вполне возможен этот вариант, чтобы исключить волнение и неприятные ощущения.
Как осуществляется контроль за выполнением эндоваскулярного вмешательства?
Достаточно часто требуется уточнение строения дефекта, тогда на этом этапе выполняют ангиографию – рентгеноконтрастное исследование сосудов. Окклюдер подбирают индивидуально, его помещают в катетер и доводят до сердца. Затем, под контролем с помощью видеоизображений, производится установка и раскрытие окклюдера.
Если требуется дополнительный контроль над работой сердца, то используют эхокардиограф с датчиком, помещаемым в пищевод. Чреспищеводная Эхокардиография позволяет наблюдать за состоянием сердечной мышцы в режиме реального времени.
Как проводится реабилитация после манипуляции?
Общий срок проведения операции – не более 1,5-2 часов. Обычно процедура занимает около часа. Госпитализация производится на срок от суток до недели – зависит от индивидуального состояния пациента. После операции назначают прием антикоагулянтов – препаратов, препятствующих образованию тромба, а также антибиотиков, которые позволяют избежать бактериальной инфекции сердца.
Если в послеоперационном периоде не возникает осложнений, то требуется контрольное обследование через 3-4 недели. Иногда возникают такие симптомы, как боли и одышка. При появлении осложнений необходимо обратиться к лечащему врачу – при правильно проведенной операции побочные эффекты не развиваются.
Правое предсердие
Функциональная анатомия правого предсердия
Правое предсердие имеет цилиндрическую форму; у новорожденных объем
полости составляет 6,5-10 см3, к концу 1 года жизни — 11-18
см3, в 7-9 лет — 22-36 см3, в 18-25 лет — 100-150
см3.
Правое предсердие изучают в двухмерном режиме из проекции 4-х камер
с верхушки или субксифоидально. При субксифоидальном доступе можно
визуализировать место впадения нижней полой вены, а также ее заслонку
(складка эндокарда высотой 5-10 мм) и межвенозный бугорок (на границе
устьев верхней и нижней полой вены). На латеральной стенке правого
предсердия в ряде случаев удается визуализировать мышечный валик (пограничный
гребень ушка правого предсердия). При дилатации ушка могут визуализироваться
гребенчатые мышцы в виде трабекулярных образований, обычно соединяющихся
с устьем полых вен.
Размеры правого предсердия зависят от возраста: у новорожденных и
детей до года переднезадний размер колеблется от 1,1 до 2,1 см, у
детей 1-6 лет — 1,1-2,5 см, у детей 7-12 лет — 1,3-2,5 см, 13-17
лет — 1,4-2,5 см. Ширина предсердия у новорожденных и детей до 1
года от 1,2 до 1,9 см, у детей 1-6 лет — 1,2-2,3 см, у детей 7-12
лет — 1,3-2,3 см, у 13-17-летних — 1,4-2,3 см.
Двухмерная эхокардиография правого предсердия
Правое предсердие визуализируют в нескольких продольных и поперечных
сечениях. Из субкостального доступа определяют место впадения нижней
полой вены в полость камеры (situs solitus). В проекции 4-х камер
из апикального или субкостального доступа устанавливают форму камеры,
наличие в ней дополнительных образований, взаимосвязь с желудочковой
камерой.
Дилатация правого предсердия
- Идиопатическая аневризма правого предсердия.
- Аномальный дренаж легочных вен.
- Дефект межпредсердной перегородки.
- Открытый атриовентрикулярный канал.
- Аномалия Эбштейна.
- Стеноз трикуспидального клапана.
- Недостаточность трикуспидального клапана.
- Опухоль правого предсердия.
- Рестриктивная кардиомиопатия.
- Аритмогенная дисплазия правого желудочка.
- Частичное врожденное отсутствие перикарда.
- Легочное сердце.
- Застойная сердечная недостаточность.
- Констриктивный перикардит.
- Прорыв аневризмы синуса Вальсальвы в правое предсердие.
- Портальная гипертензия.
Уменьшение полости правого предсердия
- Сдавление при опухолях средостения.
- Синдром гипоплазии правого желудочка.
- Большой лево-правый шунт на уровне желудочков (ДМЖП)
или магистральных сосудов (ОАП).
Дополнительные эхосигналы в полости правого предсердия:
- Опухоли правого предсердия (чаще миксомы).
- Заслонка венечного синуса.
- Заслонка нижней полой вены (Евстахиев клапан).
- Заслонка овального отверстия.
- Гребенчатые мышцы ушка правого предсердия.
- Тромб в правом предсердии.
- Пролапс трикуспидального клапана.
- Пролапс клапана нижней полой вены.
- Аневризма межпредсердной перегородки.
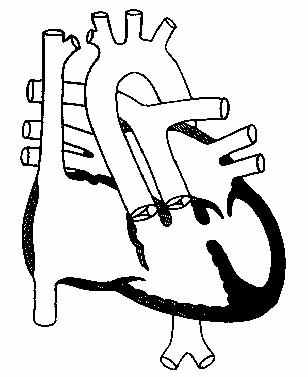
Классификация дефектов межжелудочковой перегородки
Согласно Международной классификации болезней 10 пересмотра (МКБ-10), любой ДМЖП кодируется шифром – Q 21.0. Однако в практической педиатрии врачи выделяют четыре анатомических типа данной аномалии, согласно «Клиническим рекомендациям по ведению детей с врожденными пороками сердца», утвержденным Ассоциацией сердечно-сосудистых хирургов в 2013 году:
- Субартериальный дефект межжелудочковой перегородки. Располагается непосредственно под клапаном легочной артерии. Листок аорты может «прогибаться», «вклиниваться» в существующее отверстие, что вызывает аортальную регургитацию (обратный сброс крови).
- Перимембранозный дефект межжелудочковой перегородки – отверстие располагается в мембранной части, прилегающей к трехстворчатому клапану. Мембранозная перегородка может срастаться с дефектом, отчасти прикрывая его.
- Приточный дефект межжелудочковой перегородки – локализуется в приточной части правого желудочка.
- Мышечный дефект межжелудочковой перегородки — может располагаться по центру мышцы, в верхней части, а также — на границе между стенкой правого желудочка и самой перегородкой. Иногда определяются сразу несколько мелких отверстий (множественный тип мышечного ДМЖП – болезнь Толочинова-Роже).
Чтобы вас не пугали медицинские термины, и стало понятно, где именно отверстие в межжелудочковой перегородке у вашего ребенка, попробую объяснить ещё. Анатомы разделяют эту структуру на три части – верхнюю (мембранозную), среднюю (мышечную), нижнюю (трабекулярную). Следовательно, трабекулярный изъян располагается в нижней, мышечный – в средней, мембранозный дефект межжелудочковой перегородки – в верхней её части.
Лечение дефекта межпредсердной перегородки
На данный момент существует два вида оперативного лечения:
- 1. Операция на открытом сердце в условиях искусственного кровообращения с ушиванием дефекта или его пластикой заплатой из перикарда.
- 2. Устранение дефекта межпредсердной перегородки с использованием специальных устройств (окклюдеров) в условиях рентгеноперационной через проколы артерий без стернотомии.
- Необходимо понимать, что не каждый дефект может быть устранен оперативным путем, существуют противопоказания к операции (дефекты малого диаметра, тяжелая легочная гипертензия, право-левый сброс через дефект), и не каждый дефект может быть устранен с использованием оккклюдеров (сочетание дефекта с аномальным дренажом легочных вен, первичные дефекты с отсутствующим нижним краем, дефекты большого размера, сочетание дефекта с другой
- патологией сердца являются показанием к открытой операции).
- Более подробно о конкретном случае заболевания, показаниях и противопоказаниях можно узнать в процессе консультации сердечно-сосудистого хирурга (на амбулаторном приеме).
Что это такое
В норме сердечные желудочки разделены мышечной преградой уже к моменту рождения младенца. Она не только составляет треть их общей площади, но и принимает активное участие в каждом сокращении и расслаблении сердца. Органы плода получают лишь смешанную кровь. Оба желудочка новорожденного «заняты работой» примерно одинаково, этим объясняется отсутствие разницы в толщине их мышечных стенок.
Патогенез нарушения кровообращения при ДМЖП
Межжелудочковая перегородка возникает из трех различных структур, формирование её завершается к 4-5 недели беременности. Если срастания не происходит – между желудочками остается отверстие (дефект). Он может оказаться единственной аномалией развития сердца (изолированным пороком) либо сочетаться с другими врожденными изменениями анатомии, входить в структуру комбинированного порока. Сегодня мы говорим лишь о первом варианте.
В первые часы жизни вашего ребенка, после того, как малыш задышал, изменяется вся система его кровотока. Включение большого и малого кругов кровообращения «заставляет» сердце младенца перестроить свою работу:
- Значительно повышается давление в левом желудочке.
- При ДМЖП часть крови попадает не только в аорту, но и в правый желудочек, создавая для последнего дополнительную нагрузку. Специалисты называют этот процесс сбросом крови «слева — направо» (из левой половины сердца – в правую).
- Правый желудочек «вынужден» функционировать интенсивнее, чтобы перекачать «лишнюю» кровь.
Изменения гемодинамики напрямую зависят от величины и локализации дефекта. Отверстие малых размеров может закрыться у ребенка к 4-5 годам жизни самостоятельно (спонтанно). Обычно в 65-75% случаев так и происходит. При обширных дефектах «страдает» не только правый желудочек. Возрастает давление в малом круге кровообращения, возникает легочная гипертензия.
Организм малыша попытается компенсировать нагрузку:
- Увеличивается масса желудочков.
- Утолщаются стенки крупных и мелких артерий.
- Благодаря этим механизмам давление в обоих желудочках сравнивается. Несмотря на имеющееся отверстие, сброса крови какое-то время не происходит.
- Постепенно защитные силы организма истощаются, и давление в правом желудочке становится больше, чем в левом.
- Венозная кровь через дефект начнет поступать в большой круг кровообращения – синдром Эйзенменгера. Возникает декомпенсация порока. Клинически данный процесс проявляется тем, что ребенок начинает «синеть».
К счастью, при ранней диагностике и своевременном оперативном лечении этого не происходит, даже если ДМЖП имеет большие размеры. Поэтому постарайтесь прислушаться к советам своего врача. Конечно, самой лучшей операцией хирурги считают ту, которую больному делать не нужно. Но дефект межжелудочковой перегородки у новорожденного требует тщательного обследования, консультаций специалистов, дифференцированного подхода к ведению пациентов.
Левое предсердие
Левое предсердие имеет цилиндрическую форму, его объем у новорожденных
составляет 4-5 см3, к концу года достигает 10-14 см3,
к 7-9 годам 24-32 см3, 18-25 годам — 90-135 см3.
Размеры левого предсердия зависят от возраста. У детей до 1 года жизни
переднезадний размер составляет 0,8-1,7 см, у детей до 6 лет — 0,8-2,2
см, до 12 лет — 1,0-2,2 см, до 17 лет — 1,1-2,2 см. Ширина левого
предсердия у детей до 1 года жизни составляет 1-1,17 см, у детей до
6 лет — 1,1-2,1 см, 7-12 лет — 1,3-2,1 см, 13-17 лет — 1,5-2,3
см.
Одномерная эхокардиография левого предсердия
В одномерном режиме проводится визуализация передне-заднего размера
левого предсердия в IV стандартной позиции. В этой позиции ультразвуковой
луч пересекает область левого предсердия, прилежащую к атриовентрикулярному
отверстию.
Семиотика левого предсердия
Увеличение диаметра левого предсердия
- Открытый артериальный проток.
- Дефект межжелудочковой перегородки.
- Недостаточность митрального клапана.
- Стеноз митрального клапана.
- Надклапанное митральное кольцо.
- Рестриктивная кардиомиопатия.
- Гипертрофическая кардиомиопатия.
Уменьшение диаметра левого предсердия
- Синдром гипоплазии левого желудочка.
- Тотальный аномальный дренаж легочных вен.
- Компрессия левого предсердия экстракардиальной опухолью
средостения. - Большой дефект межпредсердной перегородки.
- Миксома левого предсердия.
- Тетрада Фалло.
- Аномалия Эбштейна.
- Двойное отхождение магистральных сосудов от правого
желудочка.
Увеличение экскурсии задней стенки левого предсердия
Связано с увеличением трансмитрального кровотока при различных физиологических
и патологических состояниях.
- Недостаточность митрального клапана.
- Начальные стадии гипертонической болезни.
- Гиперкинетический кардиальный синдром.
- Спортивное сердце.
Дополнительные эхосигналы в полости левого предсердия
- Надклапанное митральное кольцо.
- Тромб левого предсердия.
- Отрыв сухожильных нитей от передней митральной створки.
- Отрыв сухожильных нитей от задней митральной створки.
- Миксома левого предсердия.
- «Болтающийся» митральный клапан (floppy
mitral valve). - Подвижные бактериальные вегетации митрального клапана.
Левое предсердие изучают в нескольких сечениях: парастернальное сечение
длинной оси левого желудочка, в прекции 4-х камер с верхушки и из
эпигастрального доступа
Обращают внимание на форму камеры (в норме
она должна быть овальной), наличие внутриполостных образований, взаимосвязь
с левым желудочком
Случай из практики
В родильном отделении неонатолог заподозрила врожденную патологию сердца. Ультразвуковое обследование выявило мышечный дефект межжелудочковой перегородки у новорожденной. Специалисты кардиоцентра рекомендовали провести оперативную коррекцию до 6-месячного возраста, так как размер отверстия оказался слишком велик. Родители настроились на хирургическое лечение, но, согласно их вере, требовалось благословение пастора. А тот, увидев вполне с виду здоровую девочку, посоветовал немного повременить с операцией. Мол, она ещё совсем маленькая, порок её не беспокоит, «разрезать» всегда успеете.
На седьмом месяце жизни у малышки появились первые признаки легочной гипертензии, с которой мы пытались безуспешно бороться назначением медикаментов. На девятом — родители умоляли кардиохирургов спасти ребенка, но оперировать было поздно — развилась клиника сердечной недостаточности. В годик девочка умерла.
А вчера на прием пришел юноша. Восемнадцать лет. Возмущался, что врачи призывной комиссии его отправили на дополнительное обследование в больницу. Занимается легкой атлетикой. Мечтает поступить в военное училище. Открываю амбулаторную карту, а там – оперативное лечение по поводу ДМЖП. На груди – тонюсенькая полоска послеоперационного шрама, практически незаметная. Парень операции не помнит. Искренне не понимает, чем он болен. Просто родители в свое время не побоялись его «разрезать».