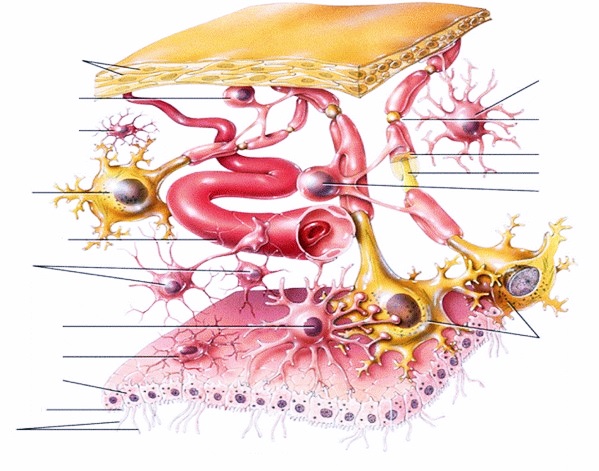
Гипоксически ишемическое поражение головного мозга
Содержание:
Возможные последствия и прогноз
Наиболее благоприятен прогноз при легкой степени заболевания. В этом случае терапия включает насыщение крови кислородом и стимуляцию нормального мозгового кровообращения. Как правило, тревожные симптомы успешно проходят в первую недели жизни малыша. Негативных последствий и неврологических нарушений при этом не наблюдается.
Во всех остальных случаях существует риск развития следующих последствий:
- нарушение развития ребенка;
- нарушение функции мозга;
- нарушение работы некоторых внутренних органов;
- местные неврологические нарушения;
- гидроцефалия;
- вегетативная дисфункция;
- эпилепсия.
Нарушение функции мозга в дальнейшем может проявляться неспособностью длительной концентрации внимания и ослаблением памяти. Высока вероятность, что такой ребенок будет плохо учиться из-за неусидчивости.
Нарушения развития могут проявляться логопедическими нарушениями и замедлением роста. В этом случае малышу показано лечение в специальных медицинских учреждениях.
Нарушение работы некоторых внутренних органов требует тщательного отслеживания симптомов и своевременного лечения при их обострениях
От этой проблемы можно избавиться только в том случае, если своевременно обратить внимание на тревожные симптомы
Гидроцефалия вследствие энцефалопатии требует своевременного лечения, в том числе и хирургического. Это заболевание также может стать причиной ряда неврологических нарушений.
При энцефалопатии тяжелой степени высок риск дальнейшего развития эпилепсии. Это связано с нарушением работы некоторых участков мозга и отмиранием нейронов, в результате чего у больных наблюдается повышение возбудимости определенных участков мозга и, как следствие, судорожные припадки. Тем не менее, своевременно начатое лечения приобретенной эпилепсии зачастую позволяет успешно избавиться от судорожных припадков.
Лечение
Чем раньше будет начато лечение энцефалопатии, тем больше шансов остановить прогрессирование патологии и восстановить полноценную работу головного мозга.
В первую очередь, необходимо устранить причину поражения нейронов:
- скорректировать уровень сахара в крови;
- стабилизировать артериальное давление;
- восстановить работу печени, почек, поджелудочной железы;
- снизить уровень холестерина в крови;
- вывести токсины;
- нормализовать уровень гормонов и т.п.
Лечение непосредственно энцефалопатии требует назначения препаратов, улучшающих кровоток в сосудах головного мозга и обмен веществ внутри клетки. В зависимости от причины и степени поражения, врачи могут назначить:
- ноотропы (церебролизин, пирацетам): направлены на усиление метаболизма;
- кроворазжижающие средства (аспирин, пентоксифиллин и т.п.): способствуют ускорению кровотока, препятствуют образованию тромбов;
- антиоксиданты: нейтрализуют токсины;
- ангиопротекторы (кавинтон, никотиновая кислота и другие): необходимы для ускорения кровообращения и обмена веществ;
- витаминно-минеральные комплексы, аминокислоты;
- симптоматические средства: успокоительные, противосудорожные препараты и т.п.
При энцефалопатии курсы лечения проводятся регулярно, минимум 2 раза в год. Это позволяет держать заболевание под контролем. Подбор конкретных препаратов и определение дозировки осуществляется только врачом. Единой схемы лечения для всех больных не существует.
Для усиления действия лекарственных препаратов используются немедикаментозные методы лечения:
- физиотерапия (рефлексотерапия, электрофорез, магнитотерапия, лазерная терапия);
- лечебная физкультура для улучшения состояния мышц, облегчения контроля за ними;
- массаж для расслабления и улучшения кровообращения;
- иглоукалывание.
В отдельных случаях (при сосудистой природе энцефалопатии) приходится прибегать к хирургическому лечению:
- устранение тромба из просвета сосудов;
- расширение суженных участков артерии с установкой стента, поддерживающего стенки в правильном положении;
- шунтирование: восстановление кровотока за счет создания альтернативного пути, обходящего пораженный участок.
Способы диагностики
Для назначения процедур обследования больного невролог изначально проводит сбор информации про пациента, узнает о наличии жалоб, проверяет итоги физикальных, лабораторных и инструментальных проверок. Общая программа исследования с вероятностью присутствия ТЭ заключается таких особенностях:
- Детальный сбор всех имеющихся жалоб и сведений — эффективно помогает определить токсин, который вызвал расстройство.
- Врач делает упор на характер речевой способности — присутствие дизартрий или бессвязности рассказа.
- Проводится стандартный осмотр тела.
- В ходе физикальной проверки у пациента измеряют пульс, меряют давление, исследуют состояние поверхностного слоя кожи и видимых слизистых полостей, оценивают объем активных и пассивных двигательных возможностей для поиска парезов, паралича и неконтролируемых подергиваний мышц.
- Проводится обследование черепных нервов, уровень зрения и слуха.
- Назначаются общеклинические лабораторные анализы (ОАК, ОАМ, биохимическое тестирование кровеносных телец).
- Прохождение электроэнцефалографии — потребуется в случае образования судорожного спазма и глубокого нарушения сознания.
- Дополнительные диагностические приемы — электромиография, взятие спинномозговой пункции, компьютерная томография или МР-сканирование мозга, токсикологическое оценка волосяного покрова и ногтей.
Список литературы
- Kurinczuk J.J., White-Koning M., Badawi N. Epidemiology of neonatal encephalopathy and hypoxic-ischaemic encephalopathy. Early Hum Dev. 2010; 86(6): 329–38. doi: 10.1016/j.earlhumdev.2010.05.010.
- Приходько А.М., Киртбая А.Р., Романов А.Ю., Баев О.Р. Биомаркеры повреждения головного мозга у новорожденных. Неонатология: новости, мнения, обучение. 2018; 7(1): 70–6. [Prikhod’ko A.M., Kirtbaya A.R., RomanovA.Yu.,Baev O.R. Biomarkers of brain damage in newborns. Neonatology: News, Opinions, Training. 2018; 7(1): 70–6. doi: 10.24411/2308-2402-2018-00009
- Douglas-Escobar M., Weiss M.D. Hypoxic-ischemic encephalopathy: a review for the clinician. JAMA Pediatr. 2015; 169(4): 397–403. doi: 10.1001/jamapediatrics.2014.3269.
- Hellström-Westas L., Rosén I. Continuous brain-function monitoring: state of the art in clinical practice. Semin Fetal Neonatal Med. 2006; 11(6): 503–11. doi: 10.1016/j.siny.2006.07.011
- Yatham S., Whelehan V., Archer A., Chandraharan E. Types of intrapartum hypoxia on the cardiotocograph (CTG): do they have any relationship with the type of brain injury in the MRI scan in term babies? J Obstet Gynaecol. 2019; 1–6. oi: 10.1080/01443615.2019.1652576.
- Lundgren C, Brudin L, Wanby AS, Blomberg M. Ante- and intrapartum risk factors for neonatal hypoxic ischemic encephalopathy. J Matern Fetal Neonatal Med. 2018; 31(12): 1595–1601. doi: 10.1080/14767058.2017.1321628.
- Alfirevic Z., Devane D., Gyte G.M.L., Cuthbert A. Continuous cardiotocography (CTG) as a form of electronic fetal monitoring (EFM) for fetal assessment during labour. Cochrane Database of Systematic Reviews. 2017; 2. Art. No.: CD006066. doi: 10.1002/14651858.CD006066.pub3
- Ayres-de-Campos D., Spong C.Y., Chandraharan E., FIGO Intrapartum Fetal Monitoring Expert Consensus Panel. FIGO consensus guidelines on intrapartum fetal monitoring: Cardiotocography. Int J Gynaecol Obstet. 2015; 131(1):13–24. . doi: 10.1016/j.ijgo.2015.06.020.
- Martinez-Biarge M., Diez-Sebastian J., Wusthoff C.J., Mercuri E., Cowan F.M. Antepartum and Intrapartum Factors Preceding Neonatal Hypoxic-Ischemic Encephalopathy. Pediatrics. 2013; 132(4): e952–9. doi: 10.1542/peds.2013-0511
- Graham E.M., Adami R.R., McKenney S.L., Jennings J.M., Burd I., Witter F.R. Diagnostic accuracy of fetal heart rate monitoring in the identification of neonatal encephalopathy. Obstet Gynecol. 2014; 124(3): 507–13. . doi: 10.1097/AOG.0000000000000424.
- Ater S.B., Murray M.L., Hunter J.V. Diagnostic accuracy of fetal heart rate monitoring in the identification of neonatal encephalopathy. Obstet Gynecol. 2014; 124(6): 1211. doi: 10.1097/AOG.0000000000000574.
- Hayes B.C., McGarvey C., Mulvany S., Kennedy J., Geary M.P., Matthews T.G., et al. A case-control study of hypoxic-ischemic encephalopathy in newborn infants at >36 weeks gestation. Am J Obstet Gynecol. 2013; 209(1): 29.e1-29.e19. doi: 10.1016/j.ajog.2013.03.023
- Kunz M.K., Loftus R.J., Nichols A.A. Incidence of uterine tachysystole in women induced with oxytocin. J Obstet Gynecol neonatal Nurs JOGNN. 2013; 42(1):12–8. doi: 10.1111/j.1552-6909.2012.01428.x.
-
Приходько А.М., Романов А.Ю., Шуклина Д.А., Баев О.Р. Показатели кислотно-основного равновесия и газовый состав артериальной и венозной пуповинной крови в норме и при гипоксии плода. Акушерство и гинекология. 2019; (2):93–7.
Поступила 07.11.2019
Принята в печать 29.11.2019
Причины развития заболеваний
- Соматические заболевания матери с явлениями хронической интоксикации.
- Острые инфекционные заболевания или обострение хронических очагов инфекции в организме матери в период беременности
- Нарушение питания и общая незрелость женщины
- Наследственные заболевания и нарушение обмена веществ
- Патологическое течение беременности ( ранние и поздние токсикозы, угроза прерывания беременности и пр.)
- Вредные воздействия окружающей среды, неблагоприятная экологическая обстановка (ионизирующее излучение, токсические воздействия, в том числе при применении различных лекарственных веществ, алкоголя, наркотиков, курение; загрязнение окружающей среды солями тяжёлых металлов и пр)
- Патологическое течение родов ( стремительные роды, слабость родовой деятельности и пр.) и травмы при применении родового пособия.
- Недоношенность и незрелость плода с различными нарушениями его жизнедеятельности в первые дни жизни.
Необходимо обратить внимание на то, что в первом триместре внутриутробной жизни закладываются все основные элементы нервной системы будущего ребёнка, а формирование плацентарного барьера начинается лишь с третьего месяца беременности. Возбудители таких инфекционных заболеваний , как токсоплазмоз, хламидиоз, листереллёз, сифилис, сывороточный гепатит, цитомегалия и др, проникнув через незрелую плаценту из организма матери, глубоко повреждают внутренние органы плода, и в том числе формирующуюся нервную систему ребёнка
Возбудители таких инфекционных заболеваний , как токсоплазмоз, хламидиоз, листереллёз, сифилис, сывороточный гепатит, цитомегалия и др, проникнув через незрелую плаценту из организма матери, глубоко повреждают внутренние органы плода, и в том числе формирующуюся нервную систему ребёнка.
Эти повреждения плода на данной стадии его развития генерализованные, но в первую очередь страдает центральная нервная система. В последующем, когда плацента уже сформировалась и достаточно эффективен плацентарный барьер, воздействия неблагоприятных факторов уже не приводит к формированию пороков развития плода, но могут вызвать преждевременное рождение, функциональную незрелость ребёнка и внутриутробную гипотрофию.
Следует заметить, что первые шесть пунктов из восьми выше перечисленых причин заболевания относятся собственно к периоду зачатия и вынашивания беременности, где главную роль играет будущая мать.
Основные варианты последствий перинатального поражения центральной нервной системы
- Полное выздоровление.
- Задержка психического, моторного или речевого развития.
- Минимальная мозговая дисфункция (синдром гиперактивности или дефицита внимания)
- Невротические реакции.
- Церебрастенический синдром.
- Синдром вегетативно-висцеральной дисфункции.
- Эпилепсия.
- Гидроцефалия.
- Детский церебральный паралич.
У детей с последствиями перинатального поражения головного мозга и оставленными родителями без внимания в более старшем возрасте часто отмечаются различные нарушения поведения, невротические проявления, синдром гиперактивности, нарушения вегетативно-висцеральных функций, астенический синдромом, частая школьная дезадаптация и т.д.
Необходимо заметить, что при своевременной диагностике в раннем детском возрасте имеющиеся нарушения нервной системы в подавляющем большинстве случаев могут быть практически полностью устранены коррекционными мероприятиями, а дети в дальнейшем жить полноценной жизнью.
С началом же занятий в школе процесс дезадаптации с проявлениями нарушений высших функций головного мозга, соматических и вегетативных симптомов, сопровождающих минимальную мозговую дисфункцию, нарастает лавинообразно.
Причины
Церебральная гипоксия может быть вызвана любым событием, которое серьезно влияет на способность мозга получать или обрабатывать кислород. Это событие может быть внутренним или внешним по отношению к телу. Легкая и умеренная формы церебральной гипоксии могут быть вызваны различными заболеваниями, нарушающими дыхание и оксигенацию крови . Тяжелая форма астмы и различные виды анемии могут вызвать некоторую степень диффузной церебральной гипоксии. Другие причины включают эпилептический статус , работу в среде, богатой азотом , всплытие после , полеты на больших высотах в негерметичной кабине без и интенсивные упражнения на большой высоте перед акклиматизацией.
Тяжелая церебральная гипоксия и аноксия обычно вызываются травматическими событиями, такими как удушье , утопление , удушение , вдыхание дыма , передозировка лекарств , раздавливание трахеи , астматический статус и шок . Кроме того, в процессе игры в обморок и при эротическом удушье она вызывается самопроизвольно .
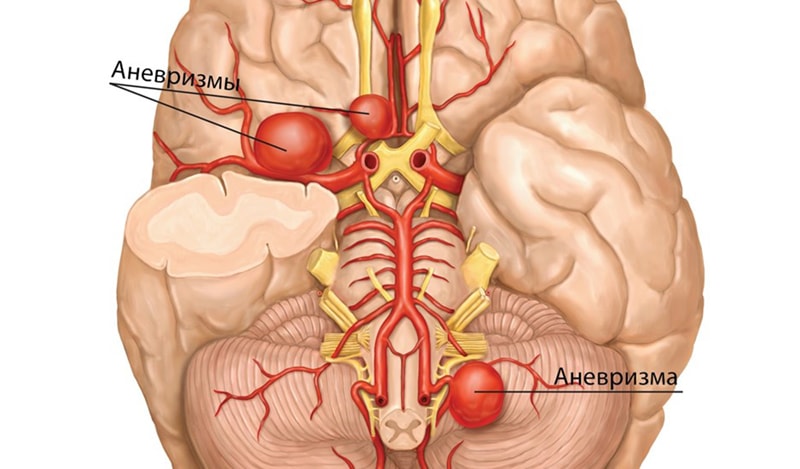
- Транзиторная ишемическая атака (ТИА) часто называется «мини-инсультом». Американская кардиологическая ассоциация и Американская ассоциация инсульта (AHA / ASA) уточнить определение транзиторной ишемической атаки. В настоящее время ТИА определяется как преходящий эпизод неврологической дисфункции, вызванный очаговой ишемией головного , спинного мозга или сетчатки без острого инфаркта . Симптомы ТИА могут исчезнуть в течение нескольких минут, в отличие от инсульта. ТИА имеют ту же основную этиологию, что и инсульты; нарушение мозгового кровотока. ТИА и инсульты имеют одни и те же симптомы, такие как контралатеральный паралич (противоположная сторона тела от пораженного полушария головного мозга) или внезапная слабость или онемение. ТИА может вызвать внезапное затемнение или потерю зрения, афазию , невнятную речь и спутанность сознания. Симптомы ТИА обычно проходят в течение 24 часов, в отличие от инсульта. Повреждение головного мозга все же может произойти при ТИА, продолжающейся всего несколько минут. ТИА — фактор риска развития инсульта.
- Тихий инсульт — это инсульт, который не имеет никаких внешних симптомов, и пациент, как правило, не подозревает, что перенес инсульт. Несмотря на отсутствие идентифицируемых симптомов, тихий инсульт по-прежнему вызывает повреждение головного мозга и подвергает пациента повышенному риску серьезного инсульта в будущем. По данным обширного исследования, проведенного в 1998 году, более 11 миллионов человек в США перенесли инсульт. Приблизительно 770 000 из этих инсультов были симптоматическими, а 11 миллионов были первыми в истории бессимптомными инфарктами или кровотечениями при МРТ . Тихие удары обычно вызывают поражения, которые обнаруживаются с помощью нейровизуализации, такой как фМРТ . Риск тихого инсульта увеличивается с возрастом, но также может возникать у более молодых людей. Похоже, что женщины подвержены повышенному риску тихого инсульта, предрасполагающими факторами которого являются гипертония и курение сигарет .
Дородовой и послеродовой
Гипоксико-аноксические явления могут влиять на плод на различных стадиях развития плода , во время родов и в послеродовой период . Проблемы во время беременности могут включать преэклампсию , материнский диабет с сосудистыми заболеваниями , врожденные инфекции плода, употребление психоактивных веществ / алкоголя, тяжелую анемию плода, сердечные заболевания, пороки развития легких или проблемы с кровотоком к плаценте .
Проблемы во время родов и родоразрешения могут включать окклюзию пуповины , перекрут или выпадение , разрыв плаценты или матки , чрезмерное кровотечение из плаценты, аномальное положение плода, такое как тазовое предлежание , длительные поздние стадии родов или очень низкое артериальное давление в грудном предлежании. мать. Проблемы после родов могут включать тяжелые преждевременные роды, тяжелые заболевания легких или сердца, серьезные инфекции, травмы мозга или черепа, врожденные пороки развития головного мозга или очень низкое кровяное давление у ребенка, а также из-за удушья в случаях синдрома Мюнхаузена по доверенности .
Тяжесть неонатального гипоксически-ишемического повреждения головного мозга можно оценить с помощью определения стадии по Sarnat , которое основывается на клинических проявлениях и результатах ЭЭГ , а также с помощью МРТ .
Диагностика и терапия
Для постановки диагноза «энцефалопатия головного мозга» используется физическое исследование и специальные клинические тесты, позволяющие определить измененное психическое состояние – координационные, памяти, на умственные способности и т.д. Огромное значение имеет и наличие первичного заболевания (аноксии, гипертонии, почечной недостаточности, проблем с печенью и др.) – такой подход обусловлен тем, что данный психоорганический синдром является лишь осложнением вышеуказанных заболеваний.
Специалист-невролог изучает список лекарств, которые принимает пациент, так как среди них могут быть и такие, которые провоцируют возникновение симптомов энцефалопатии.
Также для диагностики необходимы и следующие исследования:
- контроль артериального давления;
- развернутый анализ крови;
- метаболические тесты, подразумевающие определение содержания в крови кислорода, электролитов, аммиака, глюкозы, ферментов печени, лактата;
- замер уровня токсинов в организме, а также наркотиков и алкоголя;
- проверка функции почек;
- анализы на инфекции;
- ЭЭГ и энцефаллограмма;
- рентгенография;
- допплер-звук, позволяющий определить абсцессы и аномальный приток крови;
- МРТ и КТ – для обнаружения абсцессов, анатомических аномалий, опухолей мозга;
- анализ аутоантител.
Конечно, это не весь перечень проводимых мероприятий, но и не все они нужны для каждого пациента – конкретные исследования назначает врач индивидуально, основываясь на состоянии больного и в соответствии с имеющейся первичной болезнью.
Что касается новорожденных, то в целях своевременного обнаружения у них энцефалопатии стало практикой сразу после рождения проводить эхографию.
Схема лечения энцефалопатии головного мозга продумывается в зависимости от того, какие причины ее вызывали – принимаются меры к их устранению. Так, прописываются медикаменты, стабилизирующие давление, работу печени и почек, хондропротекторы для суставов, нейровитамины – отвечающие за работу нервных клеток в мозге витамины группы В, и т.д.
Например, при краткосрочной аннексии назначают кислородную терапию; в случае диабетической энцефалопатии при гипергликемии используют инсулин, при гипогликемии – глюкозу; уремическая энцефплопатия требует диализ или трансплантация почки; токсическая – антибиотики, лактулозу, ангиоэнцефалопатическая – препараты для снижения давления, мочегонные, улучшающие питание клеток мозга, укрепления стенок сосудов, антиоксиданты и т.д.
Естественно, что необходимо восстановление нормального кровоснабжения мозга, разжижение крови, укрепление сосудов – для этого тоже имеются определенные лекарственные средства. В тяжелых случаях необходимо провести очищение крови или хирургическое вмешательство.
Кроме фармотерапии достичь желаемого результата поможет:
- курс остеопатии;
- массаж воротниковой зоны;
- иглоукалывание;
- магнитотерапия;
- электрофорез и т.п.
Больному рекомендуется вести здоровый образ жизни, заниматься спортом, больше гулять, сбалансировано питаться, отказаться от вредных привычек. Если серьезно относится к советам лечащего врача, то можно вести нормальный образ жизни, сведя к минимуму проявления энцефалопатии. Однако если она находится в запущенном состоянии, то есть повреждение мозга и измененное психическое состояние значительны, двигательные функции нарушены, то все это не поможет – придется пройти реабилитацию. Для этого существуют специализированные неврологические центры.
Еще раз необходимо упомянуть, что очень важно вовремя начать лечение энцефалопатии головного мозга, чтобы предотвратить необратимые его повреждения и не позволить человеку впасть в кому и умереть. В первую очередь необходим точный диагноз и незамедлительное лечение основной причины синдрома – соматическое заболевание, ведь так можно избежать поражения главного органа нервной системы
Диагностика
Диагностикой и лечением энцефалопатии занимается врач невролог. Обследование пациента включает в себя:
- опрос: сбор жалоб и анамнеза; в обязательном порядке уточняются сведения о перенесенных заболеваниях, травмах, факторах риска, время появления первых нарушений, скорость развития и т.п.;
- неврологический осмотр: оценка рефлексов, чувствительности, мышечной силы, двигательной функции;
- электроэнцефалографию (ЭЭГ): оценка электрических импульсов, возникающих в процессе работы мозга; позволяет выявить признаки эпилепсии, воспаления, наличия опухолей и т.п.;
- УЗДГ сосудов головного мозга и шеи: оценивает качество кровотока в крупных сосудах, выявить участки сужения, оценить объем поступающей крови;
- реоэнцефалография: дополняет УЗДГ, позволяет оценить тонус и эластичность сосудов, обнаружить тромбы;
- ангиография: рентгенологическое исследование сосудов с помощью введения в них контрастного вещества;
- КТ и МРТ: позволяют обнаружить очаги склероза, опухоли, воспалительные очаги последствия инсульта и другие структурные изменении;
- анализы крови (общий, биохимический): дают возможность оценить работу почек, печени, поджелудочной железы, выявить токсины, которые могут повлиять на состояние головного мозга.
При необходимости могут быть назначены другие анализы и обследования, а также консультации специалистов для точного определения причины энцефалопатии.
Лечение и уход
За пострадавшими должен быть особый уход, а за детьми, перенёсшими ГИЭ, он строится на контроле за:
- температурой в помещении — не более 25 градусов;
- его комфортной позой, поэтому тугое пеленание под запретом;
- тем, чтобы свет был мягким и приглушенным;
- тишиной;
- кормлением, которое должно быть с контактом «кожа к коже» и согласно потребностям малыша;
- дыханием, при сбое в котором подключают специальный аппарат.
Терапию проводят:
- Хирургически, для восстановления и улучшения кровообращения в мозгу. Чаще всего для этих целей используют эндоваскулярную методику, которая не нарушает целостность тканей.
- Медикаментозно, выбирая препараты в зависимости от того, насколько тяжелая степень поражения и ее клинической картины.
- На антиконвульсантах, которые купируют судороги. Обычно это Фенобарбитал, дозировку которого подбирают индивидуально. Внутривенный способ самый быстрый. Но сам препарат противопоказан при сверхчувствительности, тяжелой форме гипоксической и гиперкаптической дыхательной недостаточности, проблемах с почкам и печенью, при беременности. Может быть использован Лоразепам, у него аналогичное воздействие и список противопоказаний.
- На сердечно-сосудистых средствах, чтобы увеличить системное сопротивление сосудов и сократительную функцию миокарда, что приводит к повышенному сердечному выбросу. Все средства этой группы влияют на почки, а при передозировке побочные эффекты предсказать сложно. Чаще всего используют Допамин, Добутамин.
Клинические варианты печеночной энцефалопатии
Острая энцефалопатия может развиться спонтанно под воздействием предрасполагающих факторов, особенно у больных с билирубинемией и асцитом после удаления большого количества жидкости, что, по-видимому, связано с потерей воды и электролитов. Богатая белками пища или длительные запоры могут способствовать развитию комы, а угнетение функции печеночных клеток вызвано анемией и снижением печеночного кровотока.
Пациенты с острой энцефолопатией плохо переносят хирургические операции, поскольку из-за кровопотери, анестезии и шока происходит усугубление нарушений функции печени. Развитию печеночной энцефолопатии могут способствовать инфекционные заболевания особенно в тех случаях, когда они осложняются бактериемией.
Что такое перинатальная гипоксически-ишемическая энцефалопатия?
Перинатальная гипоксически-ишемическая энцефалопатия (ГИЭ) – это следствие недостаточного кровоснабжения головного мозга ребенка во время беременности матери, родов или в течение первого месяца его жизни. Гипоксия-ишемия головного мозга является основной причиной неврологических повреждений у новорожденных. Одними из основных параметров, характеризующих тяжесть гипоксически-ишемического поражения головного мозга в родах и во время беременности, являются оценка по шкале Апгар и наличие мекония в околоплодных водах.
Последствия ГИЭ могут быть различными: от незначительного снижения внимания и неусидчивости ребенка до тяжелых форм детского церебрального паралича.
Дети с умеренной степенью поражения мозга могут выглядеть здоровыми в течение первых дней и даже месяцев жизни. Патология у них выявляется при проведении УЗИ головного мозга на первом месяце жизни, при осмотре неврологом и другими специалистами.
Детям с тяжелой формой ГИЭ и асфиксией в родах, как правило, требуется интенсивная терапия, и они проходят поэтапное лечение в родильном доме и отделении патологии новорожденных.
Перинатальная гипоксически-ишемическая энцефалопатия умеренной и тяжелой степени является одним из основных факторов риска развития ДЦП.
Течение ГИЭ очень индивидуально, но, как правило, оно сопровождается гибелью части клеток головного мозга и требует своевременного и правильного лечения. Соблюдение этого принципа позволяет добиться существенного улучшения даже при тяжелом поражении головного мозга.